一文读懂欧盟MDR新法规
MDR法规简介
2017年5月5日,欧盟官方期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。

MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不超过5年,并且于2024年5月27日失效。
1. MDR的主要变化
- 扩大了应用范围
- 提出了新的概念和器械的定义
- 细化了医疗器械的分类
- 完善了器械的通用安全和性能要求
- 加强对技术文件的要求
- 加强器械上市后的监管
- 完善临床评价相关要求
- 提出Eudamed数据库的建立和使用
- 提出器械的可追溯性(UDI)
- 对NB提出严格的要求
2. MDR适用范围扩大
新MDR不仅包含了MDD及AIMDD涵盖的所有产品;还覆盖专门用于器械的清洁、消毒或灭菌的器械,以及Annex XVI列举的无预期医疗目的的产品,如美瞳、面部填充或注射、纹身、皮肤改善和美容等产品。
3. MDR提出了新的概念和器械的定义
MDR中增加了很多新的概念,从MDD中的14个概念,增加到现在的71个,如增加了一些临床试验方面和上市后监管方面的概念,如 “recall ,withdraw ,serious incident, clinical consent, clinical benefit”。
MDCG对有关公告机构问答文件的澄清和补充,是在新法规MDR&IVDR下指定公告机构的逐步增加之后进行的。
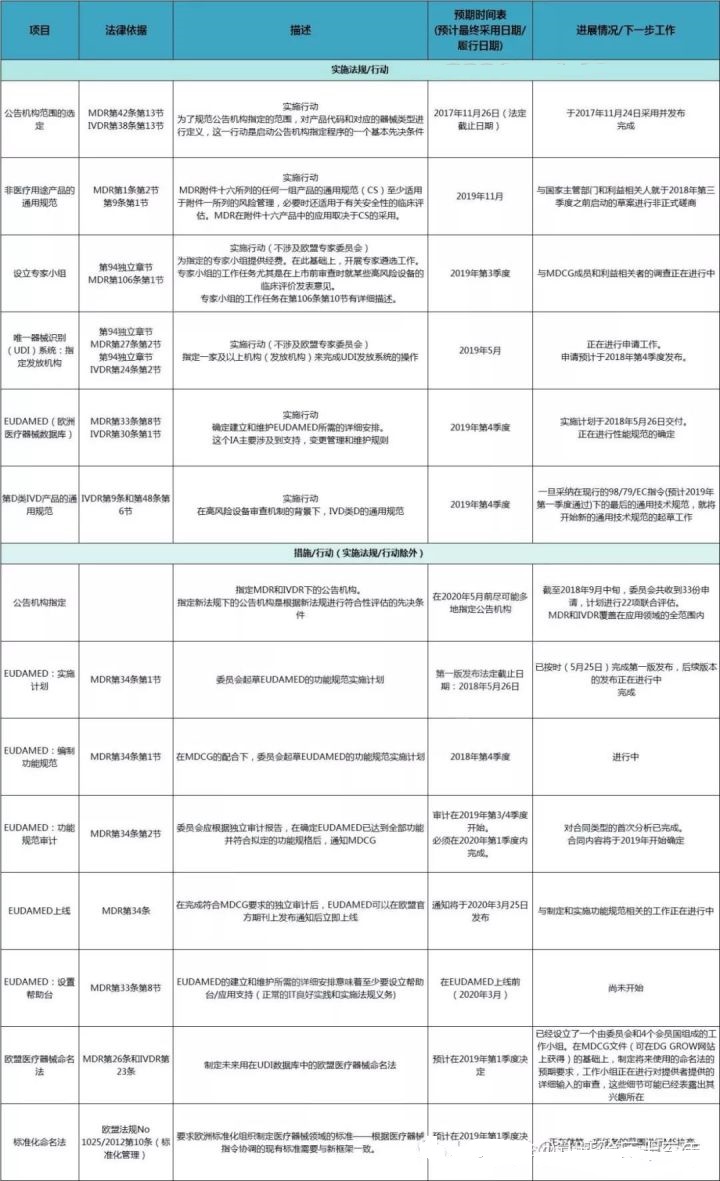
4. 欧盟发布MDR和IVDR实施的工作计划
欧盟委员会于2018年10月9日发布了一份关于新的欧盟医疗器械和体外诊断器械法规(MDR和IVDR)施行的工作计划。
在这份计划中,分别罗列了12项施行法令/法规和12项其他方面的举措或行动,并分别从与措施相关的法律依据、预期时刻表以及现在发展状况/下一步工作这几个方面对该项工作进行了详细的阐述。从发布的更新时刻计划表中能够看出,现在仅完成了一项工作,即布告组织规模的选定;其他相关工作都尚在进行中,或没有展开。
5. 器械的分类变化
从MDD到MDR,器械仍分为四大类:I类、IIa类、IIb类、III类。
MDD中与分类相关是93/42/EEC中的 Annex IX 和相应的指南MEDDEV 2. 4/1 Rev. 9;新的MDR中Article51和Annex VIII 详细阐述了产品的分类信息。主要变化是由MDD的“18条”,改为MDR的“22条”。
6. 上市后监管的技术文件
AnnexIII TECHNICAL DOCUMENTATION ON POST-MARKET SURVEILLANCE 详细说明了要按照Article83-86 编写上市后监管的文件,包含上市后监管计划、上市后监管报告或定期安全性更新报告(PSUR)。
7. 符合性声明文件
ANNEX IV EU DECLARATION OF CONFORMITY 详细说明了“符合性声明”文件包含的内容。
8. 加强器械上市后监管体系
Chapter VII POST-MARKET SURVEILLANCE, VIGILANCE AND MARKET SURVEILLANCE 着重说明上市后监管、警戒和市场监管。

医疗产品CE认证
直连专家
建立、实施和维护上市后监管体系(见Article83)
9. 完善临床评价相关要求
新法规提出:
- 要求根据Article61和附录XIV partA执行、评估、报告和更新临床评价资料;
- 提出对特定III类和IIb类器械,CER中要考虑咨询专家小组的意见;
- 对植入和III类器械,提出考虑临床研究;
- 要求CER按照PMCF取得数据进行更新;
- 针对III类和可植入器械,提出了CER更新的频率;
- 明确证明实质等同性需考虑的特点;
- 要求其与风险管理的相互作用。
10. Eudamed数据库
新法规提出:
- 明确欧洲医疗器械数据库(Eudamed)建立目的和包含的信息(Article 33);
信息的公开性:
- 要求III类器械和植入式器械,安全和临床性能信息通过Eudamed向公众开放。
11. 提出器械的可追溯性(UDI)
除定制和研究器械外,其他器械均需建立UDI系统
12. MDR法规下的欧代有什么具体要求?
MDR下的欧代相比于MDD下的欧代,要求更加严格,责任也更大。除了负有以上义务之外,还会与制造商一样为缺陷器械承担连带的法律责任。另外,授权代表应至少有一名可永久且持续听其调遣的负责法规符合性的人员,其在欧盟境内的医疗器械监管要求方面拥有必要的专业知识。必要的专业知识应表现为以下任一一种资格:

欧盟授权代表
直连专家
(a) 在完成有关成员国确认为同等学历的法律、医学、药学、工程或其他相关科学学科大学学历或学习课程后颁发的文凭、证书或其他正式资格证书,以及在体外医疗器械相关法规事务或质量管理体系方面具有至少一年专业经验;
(b) 在法规事务或与医疗器械有关的质量管理体系方面有四年的专业经验。
以上就是关于欧盟MDR新法规的相关内容,了解更多欧盟MDR新法规可以咨询【海外顾问帮】。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为医疗产品CE认证提供一站式服务,咨询电话: 400-106-2206。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








