欧盟MDD口罩CE认证攻略
1. 什么是欧盟MDD口罩?
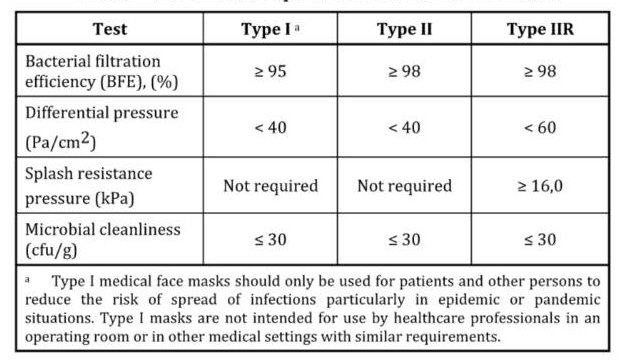
在欧盟,口罩被归类为MDD(医疗设备),分I、II或IIR3类,旨在保护患者或环境免受佩戴者的伤害。这些类别的区别在于BFE和Delta P(其中II类和IIR的效率更高)以及它们是否“防溅(R)”。
- I级MDD口罩:最低允许合格性
- II类MDD口罩:比I类更高的BFE
- IIRMDD级面罩:更高的BFE,Delta P和抗飞溅性
它们都为佩戴者提供了防止飞沫,飞溅和少见的气溶胶的有限保护,但是通常不为此目的将其作为PPE出售(与FFP呼吸器不同),但是只有IIR类实际上被评为具有防飞溅性。
为了符合EN 14683:2019的要求,面罩将进行以下测试以达到不同类型(I,II,IIR)的这些性能要求:
2. 欧盟MDD口罩CE认证流程
将口罩进口到欧盟时,获得CE标志是一个不可或缺的要素,有了此标志,口罩才可以在欧洲进口和销售。所以申请流程如下:
- 确定口罩的分类(I,II,III类)
- 选择符合欧洲统一标准(EN 14683:2019)或其他经过验证的技术规范的合格评定程序
- 选择进行性能测试的认证机构(I级MD不需要,除非以无菌形式出售)
- 实施质量管理体系(QMS)–如果制造商通过了ISO 13485医疗器械认证,则可以确保安全和质量,但是其他形式的QMS也可以接受。
- 准备技术文件(TF)或设计文件–包括物料清单(BOM),设计图纸,标签文件,包装文件,适用的EN标准或指令列表(例如EN 14683),实验室测试报告,产品质量控制检查报告,风险评估
- 任命欧盟授权代表(针对非欧洲供应商)
- 由QMS和TF的认证机构审核(I类MD不需要,除非以无菌形式出售)
- 注册医疗设备 –产品必须是要进口和销售的国家/地区的国家/地区主管部门,因为它是医疗设备
- 制造商准备合格声明(DoC)–该自我声明包括SKU,产品功能,用户手册,制造商/进口商的联系方式,适用的EN标准或指令列表(例如EN 14683),制造地点,负责人的姓名。
- 欧盟提供了草拟EC DoC的详尽指南。
- 附有CE标志 -此标志 将出现在产品及其包装上。您可以在此处阅读CE标记规定。
无菌口罩
如果口罩以无菌形式出售,则还必须获得公告机构的测试和审核。除了要求在无菌环境中生产以及可能使用不同的材料外,文档也会有所不同:
遮罩类型信息将包括“ STERILE”。
在CE标记(在物品和/或包装上)后,将包含认证机构的四位数ID,该认证机构参与产品的型式测试和审核生产。
制造商的QMS必须通过EN ISO 13485认证。
3. MDD口罩上的标签
产品和包装将显示:
- CE标志
- 标准EN 14683
- 类型; I,II或IIR
- 文章编号
- 标识有关将产品投放
- 市场的企业实体的详细信息以及CE声明签署人
- 可追溯性信息和批处理代码
- “使用日期”
海外顾问帮是协助国内企业和个人跨境发展的一站式服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为CE认证提供一站式服务,详情请咨询官方电话:400-106-2206。
版权声明:本站内容源自互联网,如有内容侵犯了你的权益,请联系删除相关内容。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司










