干货!口罩出口欧盟CE认证检查过程详解
做口罩的企业都知道口罩出口欧盟需要先获得CE标记,才可以在那边销售和使用,所以在本文中,我们将阐述如何详细检查那些要出口到欧盟的口罩(I MDD级)和FFP口罩(PPE)的CE认证。
1. 如何检查医疗器械(MD)1类口罩的CE证书?
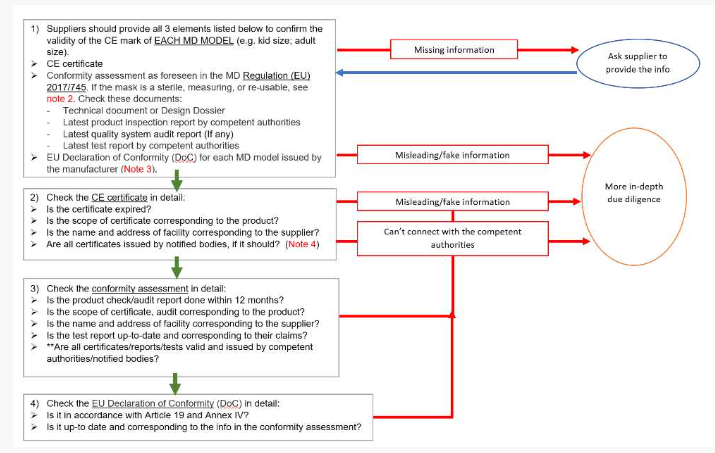
注:外科口罩仅保护环境(患者)免受佩戴者(从业者)的污染,被归类为医疗器械,属于 93/42 / EEC指令和(EU)2017/745法规的范围内。
非灭菌,不可重复使用和非测量的I类设备不需要公告机构(NB)。所有其他产品都需要指定机构的参与。
欧盟委员会关于PPE 89/686 / EEC的“分类指南”在其对7.3类的说明中进行了详细说明。“外科口罩”不属于PPE 89/686 / EEC的范围,而是作为脚注(3)添加:“如果此类口罩旨在保护穿戴者免受微生物和病毒感染等,则属于认证类别III(个人保护而非医疗用途)。”
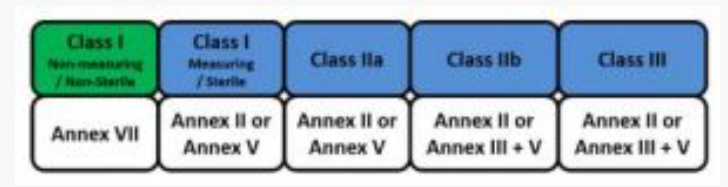
注:I类医疗设备的制造商可以从三种可能的CE标记途径中选择一种。
表1:I类医疗设备的CE标志路线
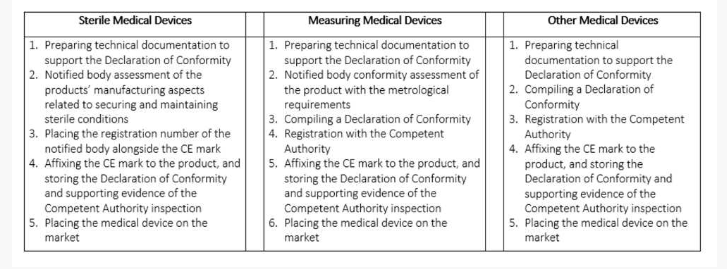
鉴于与此类设备相关的脆弱性较低,通常应由制造商全权负责I类设备的合格评定程序。
对于IIa级,IIb级和III级设备,必须强制有指定机构的适当参与级别。但是,指定机构进行的QMS审核仍然是强制性的。
指定机构应审核质量管理体系,以确定其是否满足第2.2节中提到的要求。如果制造商使用与质量管理体系有关的统一标准或通用规范CS,则指定机构应评估与这些标准或CS的符合性。
根据第52条第(7)款要求指定机构参与的I类设备的欧盟质量管理体系证书和欧盟质量保证证书应包括声明,指定机构对质量管理体系的审核仅限于该款要求的方面。
注意:理想情况下,带有MD样品和使用说明–如果有疑问,可以联系指定的机构/主管当局……
注释4:
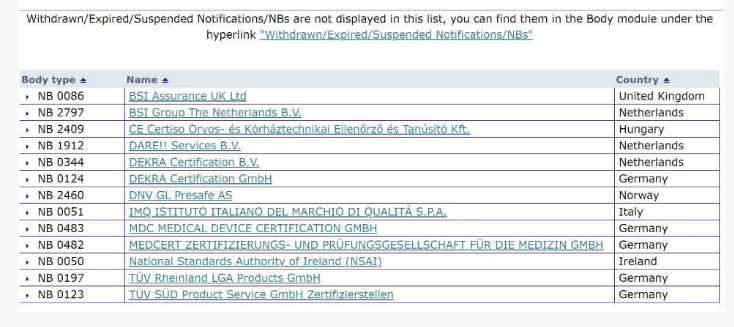
在 NANDO数据库中搜索,以确认MDD规范(EU)2017/745的指定机构。(并非所有MDD认证机构都能胜任所有类型的MDD,因此您需要检查产品范围)。
您将在此列表中看到MDD的指定机构,然后如果NB参与其中,则可以与他们联系以检查CE认证:
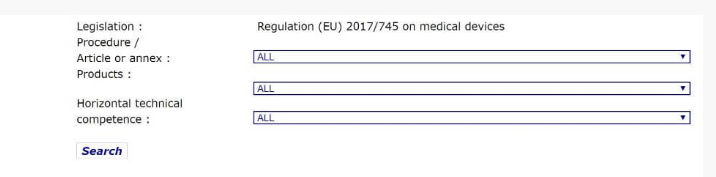
如何联系指定机构以确认报告/测试的有效性?
- 尝试直接通过这些机构的官方网站检查报告(以下是一些您可能希望检查的官方机构网站的示例:BSI,TUV Rheinland,TUV Sud)。
- 如果没有,请通过电子邮件或致电机构。
注:检查他们是否更改了设计。
仅适用于面罩(3层):
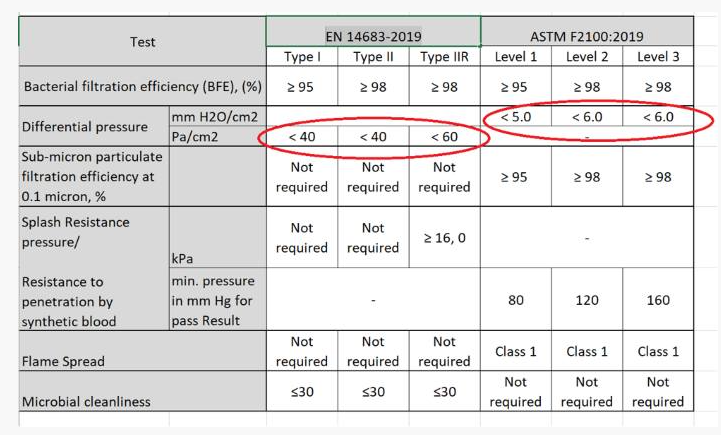
EN 14683是欧洲标准
ASTM F2100是美国标准


2. 如何检查FFP(PPE)口罩的CE证书?
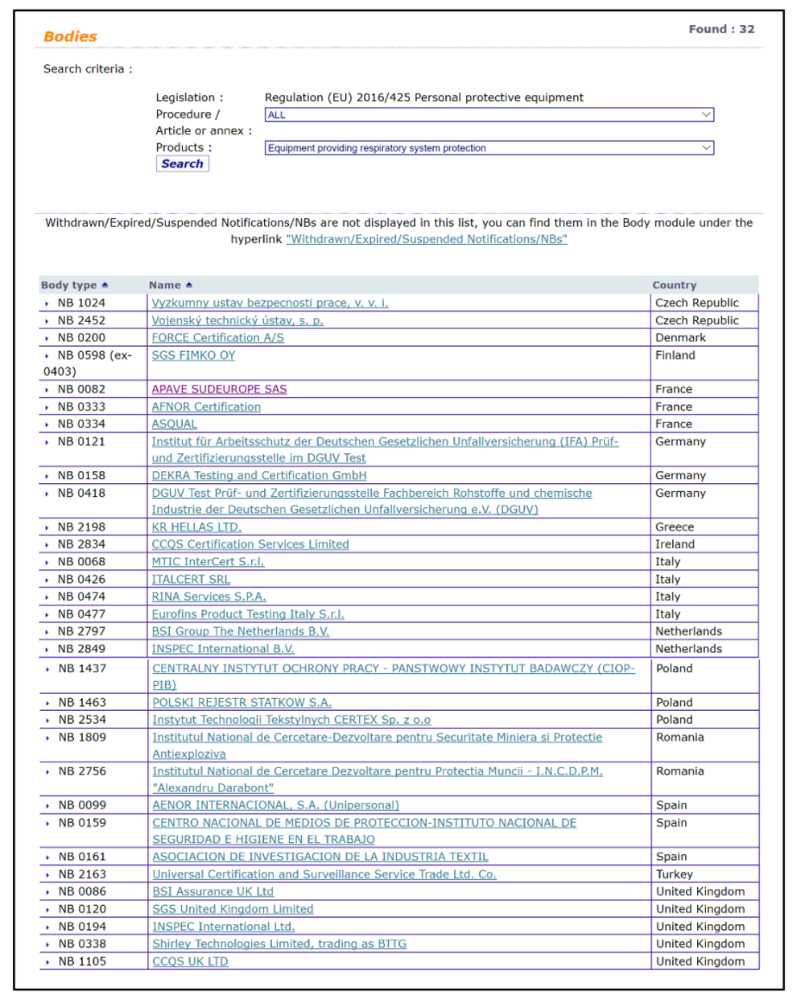
PPE产品始终需要指定的机构进行测试,因此检查其CE认证通常应与检查NANDO数据库中的“ 2016(425)法规(EU)个人防护设备”并查找用于所涉及产品的正确NB一样容易:
提供呼吸系统保护的设备只有32个,在亚洲没有,在欧洲和土耳其都有。
海外顾问帮是协助国内企业和个人跨境发展的一站式服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为有欧盟CE认证提供一站式服务,详情请咨询官方电话:400-106-2206。

欧盟CE认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








