FDA注册要求,什么是UDI,UDI的要求是什么?
医疗器械唯一标识,并不是医疗器械行业近几年新诞生的要求,而在ISO 13485体系中本身就有可追溯性要求的要素,但从行业发展的观点看,UDI是全球性的医疗器械唯一标识系统,也是全球医疗器械市场国际化发展的必然趋势。

什么是UDI?
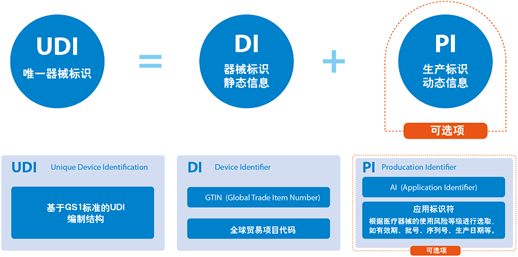
Unique device identification (UDI) 是美国食品药物管理局FDA建立的”特殊医疗器械的识别系统”,该注册码的实施是为了有效识别在美国市场上销售并使用的医疗器械,无论其生产地在哪里。一旦实施,NHRIC和NDC标签将废止,所有的医疗器械都需要将这个新的注册码作为标识贴在产品的外包装上。除了满足可见(visible)之外,UDI必须满足纯文本形式和自动识别技术(automatic identification and data capture, AIDC). 器械的标签负责人员也必须将每个产品的确实信息发送到“FDA国际特殊医疗器械识别库UDID”内,使公众可以通过访问该数据库查询并下载相关数据(包括从生产,分销到客户使用情况的信息等),但该数据库不会提供器械使用者的信息。
UDI要求的十个步骤
1. 为每一个产品确定UDI合规期限 根据医疗器械的分类,FDA的UDI合规期限跨度达六年之久。
2.获得一个邓白氏(DUNS)号码 所有的医疗器械品牌持有人必须要申请一个数据通用编号系统(DUNS)号码,因为该号码是用于在GUDID数据库中识别品牌持有人。品牌持有人不用将其名称和地址提交到GUDID数据库。这些信息都是直接从DUNS数据库中获取。
3. 为医疗器械获得GMDN代码 品牌持有人必须为提交给GUDID的每个医疗器械确定一个全球医疗设备命名(GMDN)首选术语代码。谨慎的做法是在合规日期之前为医疗器械申请好GMDN代码,因为申请周期可能会很长。
4. 算好需要多少个UDI 每个类别的医疗器械以及每个版本或者每个种类的每个规格都需要一个单独的UDI。对于每种类型的医疗器械的每个尺寸、颜色、材料、样式和包装大小,也需要一个不同的UDI。
5. 向FDA认可的发行机构申请DI码 每一个UDI必须要包含一个器械识别码(DI)。UDI的DI部分必须由FDA认可的机构颁发。目前有三家认可签发机构可供选择:新泽西州的GS1,亚利桑那州的HIBCC,和加利福尼亚州的ICCBBA。
6.选择一个PI 除I类医疗器械外,所有医疗器械的UDIs必须包含一个生产标识符(PI)。品牌持有人可选择下列一项或多项来构成UDI的PI部分: 批次或批号 序列号 有效期 生产日期 按医疗器械级别监管的人体细胞、组织或以细胞和组织为基础的产品(HCT/P)的独特识别码。

7. 确定如何将数据递交到GUDID数据库 数据可以通过FDA的web界面(允许一次提交一次)提交给GUDID,也可以卫生信息交换标准 (HL7)方式(允许一次提交多次)提交。品牌持有人必须使用GUDID测试帐户完成测试,才能通过HL7提交。
8. 指定一法规联络人 医疗器械企业必须为UDI和GUDID指定一个法规联系人。作为公司的法规联络人,Registrar Corp将为企业建立GUDID账户,帮助企业确定符合其特定产品的UDI要求,并促进FDA和公司之间的沟通。
9. 建立一个GUDID账户 品牌持有人在确定好如何向GUDID提交数据后,他们应该创建适当的GUDID账户。FDA鼓励那些选择通过web界面提交的人通过创建递交草样来熟悉系统。FDA看不到草样。
10.汇总产品信息并且递交到GUDID数据库 品牌持有需要收集关于每个医疗器械的各种信息,包括医疗器械的描述、DI码、品牌名称、版本号或型号、GMDN代码、FDA产品列名号等等。
【海外顾问帮】是协助国内企业和个人跨境发展的一站式服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA提供一站式服务,详情请咨询官方电话:400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








