ISO13485如何帮助符合MDR?
作为医疗器械制造商,如果您正在实施ISO13485:2016质量管理体系(QMS),您可能会想知道新的《欧盟医疗器械法规》(EU MDR)对您有何影响,以及您的QMS如何帮助满足这些新要求。本文将有助于解释这两个需求之间的关系。

欧盟MDR与ISO13485
重要的是要注意这两个框架之间的差异。欧盟MDR是欧盟发布的一项法规,该法规规定了想要向欧盟制造或进口医疗器械的公司需要做什么。该法规包括有关如何标记和认证医疗设备的信息,以及需要将哪些信息更新到已更新的Eudamed数据库的更新,该数据库存储了每个医疗设备的法规信息。简而言之,欧盟MDR会告诉您为欧盟市场生产医疗设备需要做什么。
另一方面,ISO13485是国际认可的标准,用于为世界各地的医疗设备公司创建QMS。任何需要证明其生产医疗设备并提供能够始终满足客户和法规要求的相关服务的组织,都可以使用ISO13485要求。如果欧盟MDR适用于在欧盟销售医疗器械的公司,则ISO13485适用于世界各地的任何公司。在此处了解更多信息:什么是ISO13485?
欧盟MDR质量管理体系
在整个欧盟MDR法规中,声明制造商需要建立质量管理体系。此QMS必须确保QMS规则涵盖所有医疗设备,确保在适当的QMS流程下使用这些设备,并建立并使用售后监控系统。
该管理系统需要由指定机构进行审核,指定机构是欧盟成员国指定的组织,负责对高级医疗设备进行评估,以认证使用QMS流程创建的医疗设备。为了使医疗器械获得认证并带有指示性的CE标志,公司必须实施QMS。
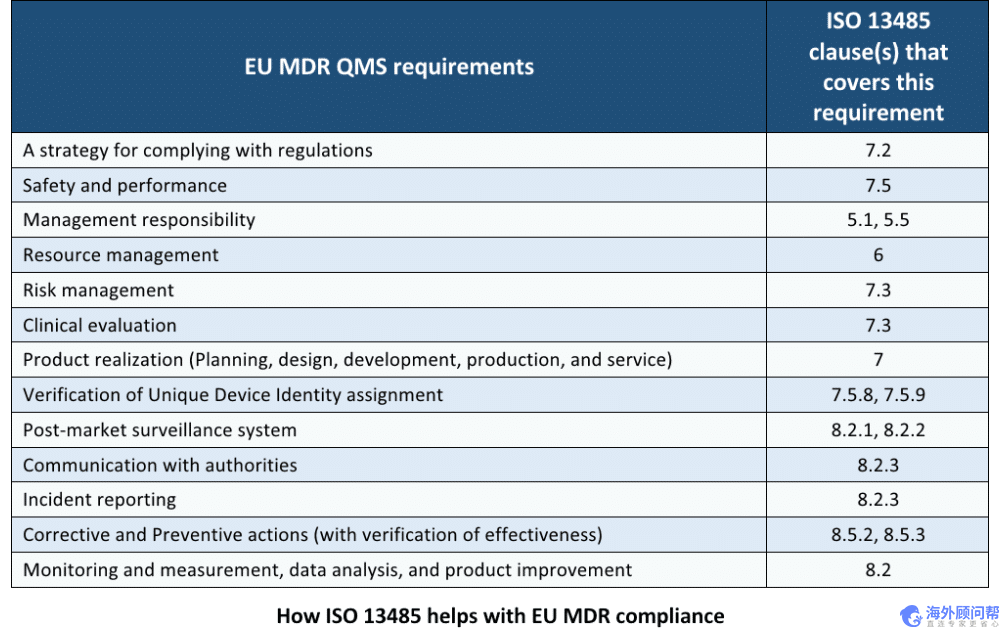
MDR QMS要求
欧盟MDR第10条中,该法规至少规定了质量管理体系中应包含的内容。至少,QMS需要解决下表中的各个方面,所有这些方面都已包含在ISO13485标准中。下表显示了欧盟MDR要求以及符合每个要求的ISO13485条款:
MDR是否必须使用ISO13485?
回答是“否”,对于符合欧盟MDR的要求,ISO13485不是必需的。但是,欧盟MDR法规要求您拥有质量管理体系,即使该体系不能直接识别ISO13485。为了帮助公司了解适用于欧盟医疗设备的所有标准,欧盟创建了统一标准列表,并且ISO13485:2016标准是该列表中唯一引用的QMS标准-因此,大多数公司使用ISO13485实施其QMS。
需要注意的重要一点是,欧盟MDR法规并未试图取代ISO13485作为QMS要求文件。欧盟MDR法规包括某些需要使用的医疗器械流程,但是ISO13485标准旨在作为一组相互关联的要求,这些要求构成了制造医疗器械公司的国际公认的最佳实践。通过使用ISO13485要求创建质量管理体系,可以确保您的医疗设备拥有世界一流的系统,而且还具有符合欧盟批准的质量管理体系标准的系统。

ISO13485质量管理体系认证
直连专家
MDR对质量管理体系的影响
那么,欧盟MDR对使用ISO13485要求实施的QMS有何影响?在大多数情况下,将需要保留其他记录以满足欧盟MDR要求。例如,ISO13485要求您维护医疗设备文件(第4.2.3节),该文件包含要包含的最少信息。但是,对于EU MDR法规,此文档将需要包括EU MDR附件II中针对医疗器械技术文件规定的所有信息。欧盟MDR还要求提供额外的上市后监督和临床评估记录。但是,您用于创建,更新和维护此文档的过程将在很大程度上保持不变。
因此,可以得出结论:您需要一个QMS才能符合EU MDR法规,尽管ISO13485没有在EU MDR法规中直接引用,但这是EU统一标准列表中唯一列出的QMS标准;因此,这间接地是根据MDR实施QMS的唯一合理方法。由于ISO13485提供了一个专用于帮助您改善质量流程的整个系统,因此除了符合MDR之外,这还具有额外的优势。

医疗产品CE认证
直连专家
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为ISO13485认证、医疗产品CE认证提供一站式服务,咨询电话: 400-106-2206。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








