美国FDA 510K申请需要提交的文件以及注册流程
FDA 510(k)提交给医疗器械的材料由美国食品药品管理局(FDA)的器械与放射卫生中心(CDRH)进行审核和处理。在提交者收到宣布设备SE的订单之前,提交者不得继续推销该设备。一旦确定该设备为SE,就可以在美国销售。SE确定通常在90天内进行,并基于提交者提交的信息进行。FDA 510(k)不是FDA批准或医疗设备的FDA认证,仅是销售许可。FDA不会通过510 k程序提供批准或证明,也不会颁发注册证书,但是您会得到510 k的编号。
请注意,FDA不执行510(k)清除前设施检查。提交者可以在获得FDA 510(k)许可后立即销售该设备。在FDA 510(k)批准后,制造商应随时准备进行FDA质量体系(QSR)检查。
FDA没有规定谁必须申请510(k)。相反,他们指定需要向FDA 510(k)提交的操作(例如,将设备引入美国市场)。
以下四类参与者必须提交FDA 510(k)
1. 国内制造商将设备引入美国市场;
如果成品设备制造商根据自己的规格制造设备并在美国销售,则必须提交FDA 510(k)附件,销售给最终用户的成品设备也被视为成品设备。但是,设备组件的制造商不需要提交510(k),除非此类组件被促销作为替代零件出售给最终用户。合同制造商,即根据其他人的规范按照合同制造设备的公司,无需提交FDA 510(k)。
2. 规范开发商将设备推向美国市场;
规格制定者为成品设备制定规格,但是该设备是由另一家公司或实体根据合同制造的。规范制定者提交FDA 510(k)通知,而不是合同制造商。
3. 进行标签更改或其操作会严重影响设备的重新包装器或重新贴标签器。
如果重新包装商或重新贴标签商明显改变标签或以其他方式影响设备的任何状况,则可能需要提交FDA 510(k)。重要的标签更改可能包括手册的修改,例如添加新的预期用途,删除或添加警告,禁忌症等。操作(例如消毒)可能会改变设备的状况。但是,大多数重新包装商或重新贴标签商均无需提交510(k)。
4. 向美国市场介绍设备的外国制造商/出口商或外国制造商/出口商的美国代表也需要FDA 510(k)提交
请注意,所有II类和III类设备的制造商(包括规范开发人员)和精选的I类设备在其设备开发过程中都必须遵循设计控制。510(k)的持有人必须拥有可用于现场检查期间FDA审查的设计控制文件。此外,对设备规格或制造工艺的任何更改都必须根据质量体系规定(QSR)进行,并且可能需要遵守新的510(k)。
FDA 510(K)提交的内容
- FDA医疗器械用户费用封面页
- FDA上市前审查提交封面
- FDA 510(k)求职信
- FDA 510(k)使用说明声明
- FDA 510(k)摘要或FDA 510(k)声明
- FDA真实性和准确性声明
- FDA III类摘要和认证
- 财务证明或披露声明
- FDA符合性声明和摘要报告
- FDA 510(k)执行摘要
- 医疗器械说明
- FDA 510(k)实质等效性讨论
- 建议的标签
- 灭菌和保质期
- 生物相容性
- 软件
- 电磁兼容性和电气安全
- 性能测试台
- 性能测试-动物
- 性能测试-临床
- 其他
需要注意的是没有510(k)表格。
FDA建议在传统或缩写510(k)中包括列出的标题,最好按以下顺序排列。在某些情况下,特定部分中的信息可能不适用于您的设备。为了加快审核速度,FDA建议您按列出的顺序保留各节的标题。
1. 医疗设备用户费用封面。
医疗设备用户费用封面页和用户费用付款收据,允许FDA开始处理您的提交;因此,您应随510(k)提交的内容一起提供“医疗器械用户费用封面”。
2. CDRH上市前审查提交封面。
CDRH上市前审查提交封面纸是一种自愿表格,用于帮助提供所有类型的上市前通知提交的基本管理信息。
3. 510(k)求职信。
FDA建议您在提交的文件中随附510(k)求职信。
4. 使用说明声明。
FDA建议您使用此部分提供使用说明声明,该文档是您在其中标识和描述510(k)提交中所包括的设备使用说明的特定说明的文档。您的使用说明声明应与510(k)提交的其余部分中列出的使用说明完全相同,包括在设备标签中使用的说明。
5. 510(k)摘要或510(k)声明。
每个510(k)提交的内容都必须包括510(k)摘要或510(k)声明FDA建议您使用第5节提供510(k)摘要或510(k)声明。510(k)摘要提供了510(k)中包含的设备的简要摘要以及支持信息。510(k)声明是对510(k)持有人将提供510(k)提交副本的证明,但有某些例外情况。
6. 真实而准确的声明。
所有510(k)必须包含声明,以证明510(k)中提交的所有信息都是真实准确的,并且没有遗漏任何重要事实。提交者应在声明上签名并注明日期。
7. III类摘要和认证。
如果您的510(k)适用于FDA未要求PMA归类为III类的设备,则它必须包含III类摘要和认证。III类摘要和认证提供对已知风险以及与拟议设备所属于的设备的一般类别相关的不良事件的审查。
8. 财务证明或披露声明。
如果您从临床研究中提交信息,则必须为参加您的研究的每个临床研究者提交财务证明和/或披露声明。
9. 符合性声明和摘要报告。
如果您的510(k)是510(k)的缩写,则FDA建议您使用此部分提供有关任何符合标准的声明或任何相关设备特定指南中建议的摘要报告的信息。
10. 执行摘要。
FDA建议您在510(k)的这一部分中提供510(k)的执行摘要,其中应包括。
- 设备的简要说明,包括使用说明和技术
- 设备比较表
- 提交中任何性能测试的简要摘要
11. 设备说明。
FDA建议您描述性能规格,并在本节中简要介绍设备设计要求。FDA还建议您确定提交文件中包括的所有型号以及所有附件或组件。如果图表,尺寸,公差和/或示意图可用于全面描述和表征设备,FDA建议您为510(k)提交文件中包括的每个设备,附件或组件都包括它们。FDA还建议您提供所有患者接触组件及其各自材料的清单。

美国FDA认证
直连专家
12. 实质等效讨论。
FDA建议您在实质等效部分中,确定要提供的谓词,以提供设备与谓词之间的详细比较,以充分证明这些实质等效性。
13. 建议的标签。
510(k)必须包括足够详细的建议标签。通常,术语“标签”包括设备标签,使用说明和任何患者标签。
14. 灭菌和保质期。
对于以无菌形式出售的设备,FDA建议您遵循FDA指南。对于确定设备保质期的呈件,应通过适当的台式测试和/或灭菌(包装)验证来支持您的保质期。
15. 生物相容性。
如果您的设备包含直接或间接与患者接触的组件,则应评估与患者接触的材料的生物相容性。
16. 软件。
本部分应包括FDA指南中所述的适当软件文档。
17. 电磁兼容性和电气安全。
如果您的设备设计包含电子组件,则FDA建议您评估其电磁兼容性(EMC)。EMC包括发射(对电子产品的干扰)和抗扰性(对其他电子产品的发射所产生的设备性能的干扰)。
18. 性能测试平台。
如果您提交基准测试结果以支持实质等效,FDA建议您在本节中包括以下信息。您应描述基准测试并提供支持设备性能特征的结果。通常,所有提交的内容都应包括以下信息。
- 列出进行的具体基准测试
- 描述每个测试协议
- 总结结果
- 描述你的分析
- 讨论你的结论
19. 性能测试-动物。
如果您进行了动物测试,FDA建议您描述测试并提供支持设备性能特征的结果。通常,所有描述动物试验的材料都应包括以下信息;但是,如果有特定于设备的相关指南,则应遵循该指南文档中的建议。
- 列出进行的特定动物测试
- 描述每个测试协议
- 总结结果
- 描述你的分析
- 讨论你的结论
20. 性能测试-临床。
如果您的呈件描述了临床研究,则FDA建议您提供可识别以下内容的临床方案:
- 测试目的
- 测试方法和程序(包括任何特定的测试条件)
- 研究终点(通常既安全又有效)
- 使用的统计方法
FDA 510(K)测试流程图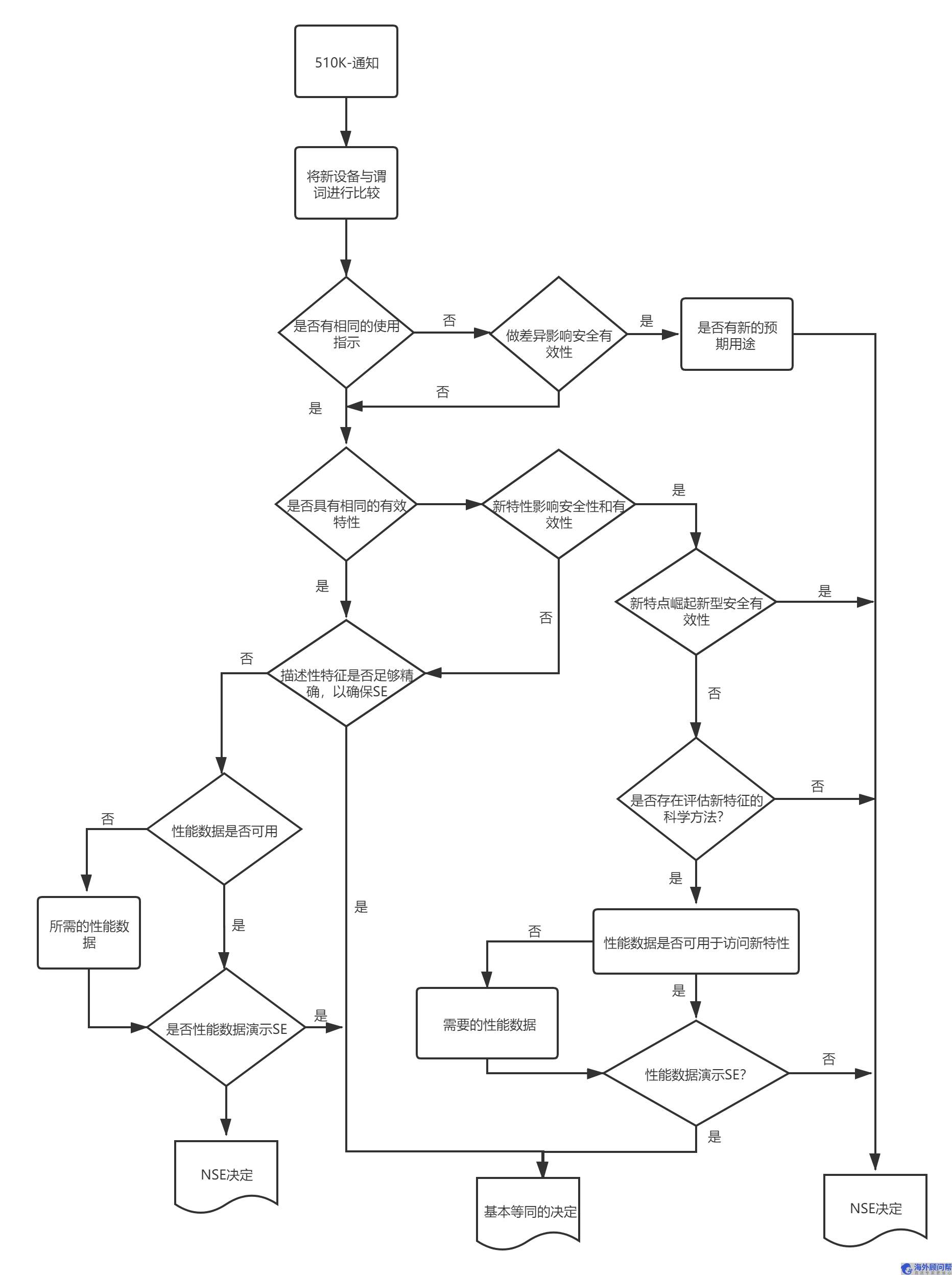
以上就是关于“美国FDA 510K申请需要提交的文件以及注册流程”的相关内容,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA510K认证提供一站式服务,咨询电话: 400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








