欧盟医疗器械IVDD产品分类以及认证流程
根据不同的医疗器械产品分类,欧盟曾先后颁发了3个有关医疗器械产品的指令,以此协调欧洲各国的医疗器械产品的管理规范。世界各国的医疗器械生产商想要将自己产品打入欧洲市场都必须遵循上述规定。国内生产商若想开发欧洲市场,必须要获得欧盟的CE认证,这也是获得向欧盟市场出口医疗器械产品的资质。

这3个有关医疗器械产品准入的指令分别是:有源植入式医疗器械指令(AIMDD,90/335/EEC)、医疗器械指令(MDD,93/42/EEC)和体外诊断器械指令(IVDD,98/79EEC)。在上述3个指令中,以第2个指令(MDD)的适用范围最广,几乎囊括了所有出口医疗器械产品,如卫生材料和医用敷料、医用导管、呼吸机、各类内窥镜和病人监护仪等。而第2个指令虽然适用范围面小,但在医疗领域确是非常重要而关键的部分。下面我们就重点介绍一下IVDD。

IVDD产品分类
根据98/79/EC(IVDD)指令附录2确定产品分类原则对有认证需求的产品进行分类。分类的依据是产品所诊断的疾病。常见产品的分类可参考下表:
| 分 类 |
主 要 产 品 |
| List A |
艾滋病诊断试剂(包括HIV1/2 抗体、P24抗原、核酸等) 乙型肝炎诊断试剂(包括二对半、抗HBcIgM、核酸等) 丙型肝炎诊断试剂(包括HCV抗体、抗原、核酸等) 丁型肝炎诊断试剂 人T细胞白血病病毒(HTLV-I/II)诊断试剂 血型分型试剂(ABO系统和rhesus (C, c, D, E, e) anti-Kell系统) |
| List B |
传染病类:风疹、弓型虫、巨细胞病毒、衣原体诊断试剂 肿瘤标志物类:前列腺特异抗原诊断试剂 遗传与优生类:trisomy 21风险检测试剂、苯丙酮尿症诊断试剂 移植类:组织相容性复合物试剂盒(HLA DR、A、B) 血型分型试剂(anti-Duffy和anti-Kidd系统) irregular anti-erythrocytic antibodies检测试剂 自测试血糖检测试剂 |
| Self-Testing |
所有供非专业人员自行使用的试剂盒(血糖除外) |
| General/Other |
未列入上述范围的其他试剂 |
与上述诊断试剂配套使用的校准品、仪器、标本采集保存用具均属于体外诊断器械指令管理的范畴。
IVDD产品欧洲协调标准
| 标准号 | 内容 |
| EN375标准 | 制造商随IVD提供的专业使用信息 |
| EN376标准 | 制造商随IVD提供的用于自检的信息 |
| EN591标准 | 专业IVD仪器使用说明 |
| EN592标准 | 体外诊断仪自检使用说明书 |
| EN12287标准 | 定量测量标准物质的描述 |
| EN12286标准 | IVD工程量测量参考测量程序的介绍 |
| EN13532标准 | 体外诊断医疗器械自检通用要求 |
| EN13612标准 | 体外诊断医疗器械的性能评价 |
| EN13641标准 | 消除或降低与IVD试剂相关的感染风险 |
| prEN13975标准 | IVD统计特性验收试验用取样程序 |
| prEN14136 | 外部质量评估方案在体外诊断程序性能评估中的应用 |
| prEN ISO18153草案 | 酶催化浓度值的计量溯源 |
IVDD认证流程
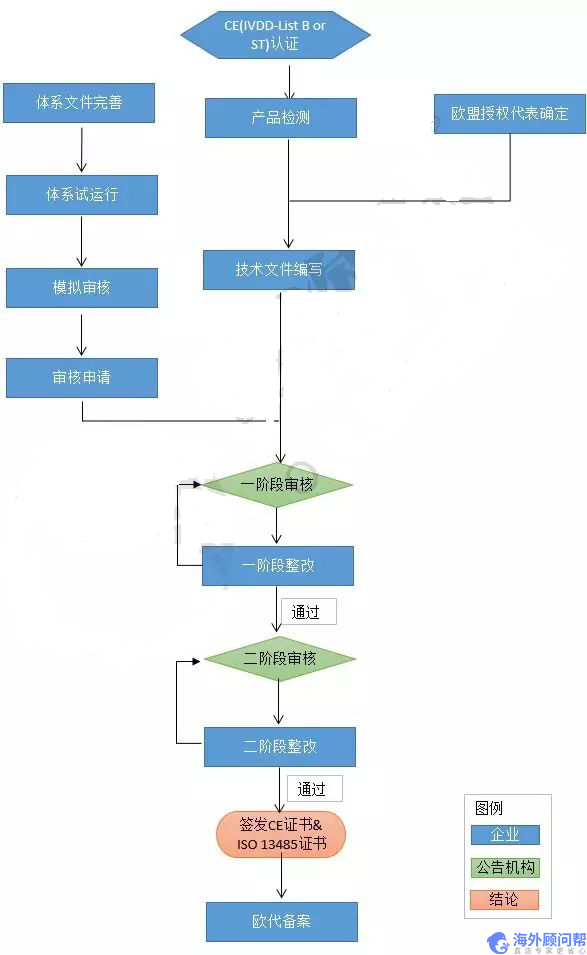
以上就是关于“欧盟医疗器械ivdd产品分类及认证流程“的相关内容,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为医疗产品CE认证提供一站式服务,咨询电话: 400-106-2206。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








