丁腈手套美国的FDA510k申请流程
为了避免和病人直接接触,医生在为病人检查时需要带手套,该手套可以是检查手套或外科手套,材质通常为乳胶,丁腈或者PVC材料,有一定的拉伸性能,有灭菌的不灭菌的。该检查手套虽然属于FDAI类产品,但是仍需要提交510k上市前评估。下面我们就来看下丁腈手套美国的fda510k申请流程。
丁腈手套FDA510k生物相容性测试
生物相容性测试是FDA 510k手套提交中的关键部分之一。FDA审查了测试方案和测试结果。如果在生物相容性测试中使用的方案未获批准,即使测试结果显示“通过”,FDA也不会向您的510k通知发出实质性等效(SE)信函。
以下是丁腈手套的强制性测试要求。
- ISO 10993-10医疗器械生物学评估刺激性测试
- ISO 10993-10医疗器械对皮肤过敏的生物评估测试
- ISO 10993-5医疗器械的生物学评估体外细胞毒性测试
- ISO 10993-11医疗器械的生物学评估全身毒性测试
丁腈手套所需的FDA510k测试要求
生物相容性测试是FDA 510k提交中用于检查和手术手套的强制性部分,大多数情况下,这些测试是在第三方实验室进行的。除生物相容性测试外,还必须在510k通知中进行以下内部测试,并且测试结果必须符合批准的标准,例如ASTM和ISO。
- 保质期测试
- 手套尺寸测试
- 物理性能测试
- 1000毫升防水测试
- 残余EO测试-用于EO灭菌手套
- 蛋白质含量测试-手套标签上是否含有蛋白质含量
丁腈手套FDA510k标签要求
美国FDA将标签定义为“在任何物品的直接包装上显示书面,印刷或图形的东西”。FDA对丁腈手套的基本要求在下面列出,这并不是最终版,要求可能会发生变化。
- 营业名称和地点
- 身份声明
- 符合语言要求
- 净含量表
- 充分的使用说明
- 天然胶乳的警告声明
- 蛋白质标签声明的警告声明
- 截止日期
- 确定符合的标准
- 批号
- 出生国家
丁腈手套FDA510k的提交内容
对于在美国销售的检查和手术手套,必须经过510 k许可。FDA对510k通知的审查时间为3个月,但实际上,可能需要6个月或更长时间,具体取决于510k文档的完善程度。FDA发布了乳胶和丁腈(检查和手术)手套510k提交的指导文件。
- 丁腈手套的内容510k通知
- FDA表格3601-医疗设备用户费用封面
- FDA表格3514 -CDRH上市前审查提交封面页
- 表中的内容
- 510 k求职信
- 使用说明声明
- 510 k摘要
- 真实准确的声明
- 符合性声明
- 执行摘要
- 设备说明
- 特殊标签声明
- 蛋白质含量声称
- 色香味添加剂
- 爽身粉
- 制造的简要说明
- 丁腈复配配方
- 实质等效讨论
- 标签,标签和广告
- 灭菌和保质期
- 生物相容性测试
- 物理性能测试
- 1000毫升水测试
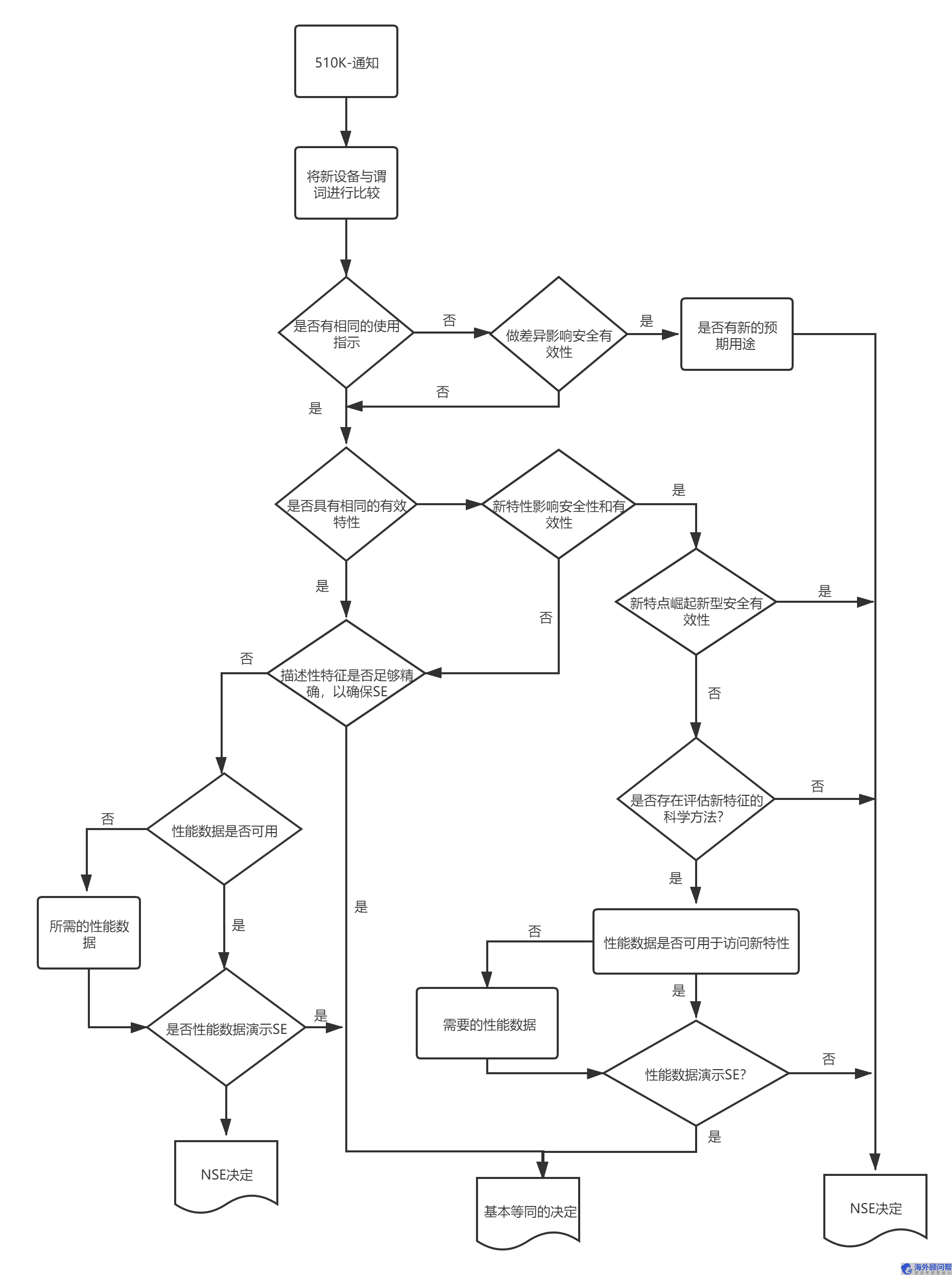
丁腈手套FDA510k申请流程图
以上就是关于”丁腈手套美国的FDA510k申请流程“的相关内容,了解更多请咨询在线客服。【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务 ,截止目前已经为数十家企业获得了510k申请, 咨询电话: 400-106-2206。


美国FDA认证
推荐指数:
项目简介:食品、化妆品、医疗器械、激光辐射产品等FDA认证,510(k)注册,FDA验厂指导,DUNS申请,美国代理人服务 查看详情>>
直连专家
版权声明:本站内容源自互联网,如有内容侵犯了你的权益,请联系删除相关内容。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司









