出口欧盟的医疗器械企业应为欧盟新医疗器械法规MDR做好7件事的准备!
新的欧盟医疗器械法规(MDR 2017/745)代表了欧盟医疗器械监管方式的重大变化。遵守新法规对RA/QA专业人员提出了一系列全新的挑战,理解这些变化并制定合理的过渡策略是非常关键的。

新的欧洲医疗器械法规是如何产生的?
2017年4月,欧盟通过了医疗器械法规(MDR),以取代现有的医疗器械指令(93/42/EEC)。在两起涉及髋关节和隆胸的医疗器械监管丑闻曝光后,新法规旨在通过提高器械质量来提高患者安全。它还涉及自1993年发布医疗器械指令以来发生的行业变化。一项单独的体外诊断法规(IVDR)允许欧盟更好地解决医疗器械和IVD之间的关键区别。
新的欧盟MDR法规包括一个多年的过渡期,“申请日期”(当它成为强制性时)为2020年5月26日。
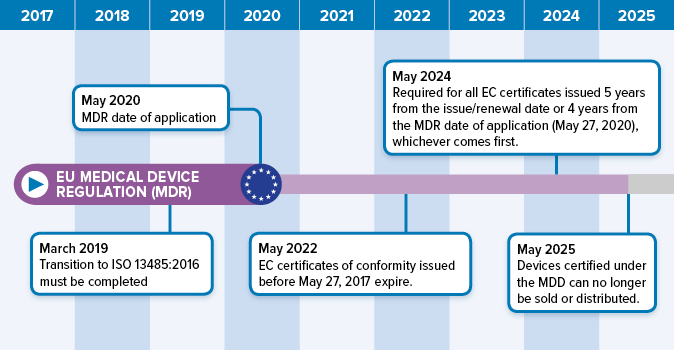
欧盟医疗器械法规2017/745的过渡时间表
MDD是一个指令,MDR是一项法规,他们有什么区别?
在欧盟范围内,一项法规类似于国家法律,但它适用于所有欧盟国家。
法规的好处是一致性:它确保在整个欧盟范围内同时执行相同的要求。一项指令包含了欧盟成员国将其转化为本国法律的一般规则。每个会员国都以适合本国的方式这样做。这就是为什么在MDD下,一些欧盟国家,如法国、意大利、波兰、西班牙、葡萄牙和德国,在指令规定之外还有额外的要求。
新医疗器械监管有什么变化?
1. 扩展的设备定义要求您重新检查所有设备的当前分类
欧盟MDR带来了设备分类的变化。例如,欧盟MDR引入了一个新的“I类,可重复使用的外科器械”类别,并扩展了医疗器械的定义,以涵盖医疗保健行业中使用的越来越新颖和复杂的产品,例如软件。欧盟MDR还强化了医疗器械的定义。新的欧盟MDR分类规则将直接影响:
- 软件
- 纳米材料
- 非外科侵入性设备
- 由通过身体孔引入或应用于皮肤的物质组成的装置
- 具有集成诊断功能的主动治疗设备,可显著影响患者管理设备的方式
- 无预期医疗用途的产品,如不可吸收的真皮填充物或吸脂器械
最后,欧盟MDR将符合性评估路线从6种方法整合到了三种方法,但在路线内提出了更多要求,包括实施完全符合要求的质量管理体系的要求。
需要考虑的关键问题:
- 您的设备的分类是否根据欧盟MDR进行了更改?
- 您将为您的产品选择哪一条合格评定路线?
2. 现在几乎每个人都需要一个质量管理体系
新的欧盟MDR要求制造商、分销商和进口商实施全面的质量管理体系(QMS)。大多数公司通过获得ISO 13485:2016认证来满足这一要求,尽管符合ISO 13485:2016的QMS不能满足欧盟MDR中规定的所有新要求,如下所示。本法规包括与每个装置的上市后监测系统作为制造商质量管理体系的组成部分有关的具体要求。新定义的分销商和进口商在上市后监管方面的责任将有助于制造商更好地了解其设备的整个生命周期。
需要考虑的关键问题:
- 您将如何根据本法规中的质量管理体系要求对您当前的质量管理体系进行差距评估?
- 现在是时候获得认证的ISO13485质量管理体系了吗?
3. 重新检查你的技术“文件”
在制定新法规的过程中,欧盟监管机构希望打消你对安全和性能数据仍能放在一个简单的“文件”文件夹中的任何希望,因此他们将名称改为“技术文件”。严肃地说,您的临床评估(CE)技术文档是一套完整的信息,展示了设计控制、制造、风险评估、上市后等对总体安全性和性能的支持程度,基本上包括有关您的设备的所有技术信息。制造商还必须描述如何在正式程序中处理和记录技术文件的变更。技术文件和设计档案之间不再有区别。欧盟MDR的附录1将以前的“基本要求”替换为新措辞的“一般安全和性能要求”。这些要求类似,但已在某些领域进行了扩展,纳入了对有源植入式装置的要求,并引入了效益-风险比的使用。
需要考虑的关键问题:
- 您将如何应用收益-风险比率并将风险整合到您的设备设计和开发中?
- 您将如何评估当前流程与新技术文件和附件1要求之间的差距?
4. 准备更严格的临床评估要求
2016年发布的MEDDEV 2.7/1第4版扩大了对临床数据的要求,欧盟MDR加强了这一要求。医疗器械制造商必须计划、实施和记录临床评估,以证明符合附录1中的相关一般安全和性能要求。在设备的整个生命周期内,必须使用上市后的临床数据更新此评估和相关文档。此外,欧盟MDR对临床评估报告(CER)的“设备等效性”施加了更严格的限制。您需要非常仔细地审查您的CER,以确保符合新的要求。对于向即将到来的欧盟医疗器械电子报告系统(EUDAMED)报告特定事件,还有其他要求。
需要考虑的关键问题:
- 您将如何识别和解决与上市后监测、临床评估过程和必要的临床评估相关的扩展需求?
- 您将如何解决临床评估与风险管理之间的更紧密联系?
- 您打算如何持续评估设备在现场的使用情况和效益-风险比?
5. 您需要遵守新的标识和可追溯性(UDI)要求
该法规包含了新的唯一设备识别(UDI)要求。幸运的是,UDI已经被美国FDA等其他监管机构实施,因此对于大多数制造商来说,UDI并不新鲜。欧盟法规要求I类设备也在标签上提供产品标识。UDI要求对供应链中的所有经济运营商施加监管责任,以帮助确保提供给医疗机构/提供商和患者的设备的责任。欧盟法规还扩大了电子系统(EUDAMED)的使用,以管理UDI信息并提供更多信息透明度。由于您将修改包装和标签,以纳入UDI信息,如果需要,这也是考虑更换您的授权代表(EC代表)的好时机,因为他们的名字也会出现在您的包装、标签和使用说明(IFU)上。
需要考虑的关键问题:
- 你将如何实施一个UDI系统,它不仅为可追溯性分配一个数字,还包括质量体系的变更?
- 你将如何设计UDI系统以确保医疗器械的更改及其标签和包装得到适当控制?
- 您将如何识别不同监管机构和欧洲监管机构的UDI要求之间的细微差异?
6. 你的上市后监管工作需要扩大
该条例更强调上市后的活动。他们要求组织有一个基于上市后监督计划的上市后监督(PMS)系统。该计划和PMS文件必须是设备技术文件的一部分,与之前的要求有很大的不同。另一个重要的变化是,PMS被视为一个积极主动的过程,要求医疗器械制造商充分意识到他们的产品在市场上的存在。作为未雨绸缪的一部分,该条例强调必须积极监测和审查的趋势报告要求。制造商必须为每个IIa、IIb和III类设备准备定期安全更新报告(PSUR),并提交给公告机构审查。制造商还将向欧盟国防部提交警戒和上市后监测报告。
需要考虑的关键问题:
- 您将如何评估您当前的上市后活动,以了解与上市后监管相关的重要新要求的影响?
- 您将如何重新设计您的投诉处理流程,使之更具前瞻性?
- 您将如何确保上市后的监控信息与产品的风险管理、临床评估和设计更改联系起来?
7. 更强的审计要求意味着内部审计将变得更加重要
新法规加强了公告机构执行质量体系符合性审核的权力和责任。它们还加强了公告机构在与制造商的关系中的地位,包括它们对设备进行不事先通知的工厂检查和进行物理或实验室测试的权利和义务。通知机构有一项新的义务,即在收到高风险设备合格评定申请时通知专家委员会。这一要求反映了欧盟对这些设备造成的公共健康风险的更大担忧。欧洲的通知机构也在忙着准备欧盟MDR中的新要求。能够遵守现有要求的欧盟通知机构的数量继续减少,其可用性短期内不会改善。当你在欧洲销售的每一个设备时,你都会收到通知,因为在欧洲销售的每一个设备都会被延迟。随着SAP公司在2019年开始实施新的医疗器械认证计划(MDC),SAP公司也将在2019年开始强制性审核。
需要考虑的关键问题:
- 您将如何准备内部审计团队和组织进行更深入的监督评估,包括对质量管理体系的审计?
没有时间拖延
欧盟新的MDR变化是巨大的,需要大量的关注和内部资源。但是你不必须担心,我们会帮你完成过渡。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为医疗产品CE认证提供一站式服务,咨询电话: 400-106-2206。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








