FDA510(k)认证什么意思?
FDA510(k)认证什么意思?
510(k)提交是向FDA的上市前通知提交。“ 510(k)”标记是指《食品药物和化妆品法》的适用部分和小节。“上市前”标识是提醒公司,在营销产品之前,必须提交510k。最后,因为FDA并不认为510k审核过程是对您产品的认可或认可,所以使用短语的“通知”部分代替“批准”一词。

相反,510(k)审查过程是由FDA进行的审查,以确定您的产品是否符合实质等同的要求与谓词设备。FDA最初对510(k)提交的内容进行了预筛选,以验证其是否符合510内容格式的最低要求。然后,在510(k)实质审查过程中,审查者必须在实质对等决策树中回答六个问题:
- 谓词设备是否合法销售?
- 这些设备是否具有相同的预期用途?
- 这些设备是否具有相同的技术特征?
- 装置的不同技术特性是否引发了不同的安全性和有效性问题?
- 方法可以接受吗?
- 数据是否显示出实质等效性?
510(k)流程并非旨在成为FDA监管批准的主要流程。510(k)流程旨在作为一种简化方法,用于清除具有中等风险且设计相似的设备,并打算与已经在市场上出售的另一种中等风险设备一起使用。但是,该过程被设备公司操纵为漏洞,以避免需要进行临床调查的更严格的上市前批准(PMA)过程。
1. 510(k)文件包含哪些内容?
510(k)文件必须包含如下16个方面内容:
- 申请函
- 目录
- 真实性保证声明
- 器材名称
- 注册号码
- 分类
- 性能标准
- 产品标识,包括包装标识、使用说明书、包装附件、产品标示等
- 实质相等性比较(SE)
- 510(k)摘要或声明
- 产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等
- 产品的安全性与有效性,包括各种设计、测试资料
- 生物相容性
- 色素添加剂(如适用)
- 软件验证(如适用)
- 灭菌,包括灭菌方法的描述、灭菌验证、产品包装盒标识等
2. 510(k)审查程序
1)FDA在收到申请方递交的510(K)资料后,首先检查资料是否齐全,如资料齐全,则受理并给申请方发出确认信,同时给出申请受理编号(K YYXXXX),此号码也将作为正式批准后的号码;如不齐全,则要求申请方在规定时间内补充资料,否则作放弃处理。
2)FDA在受理申请后即进入内部工作程序,其中可能还会要求申请方补充一些资料。
3)在510(K)申请通过审阅后,FDA并不立即发出批准函件,而是根据产品风险等级、市场先前是否对申请方有不良反应等确定是否对制造商进行现场GMP考核,考核通过后再发给申请方正式批准函件;
4)若无需现场GMP考核,则立即发给正式批准函件。
3. FDA510(k)认证流程图
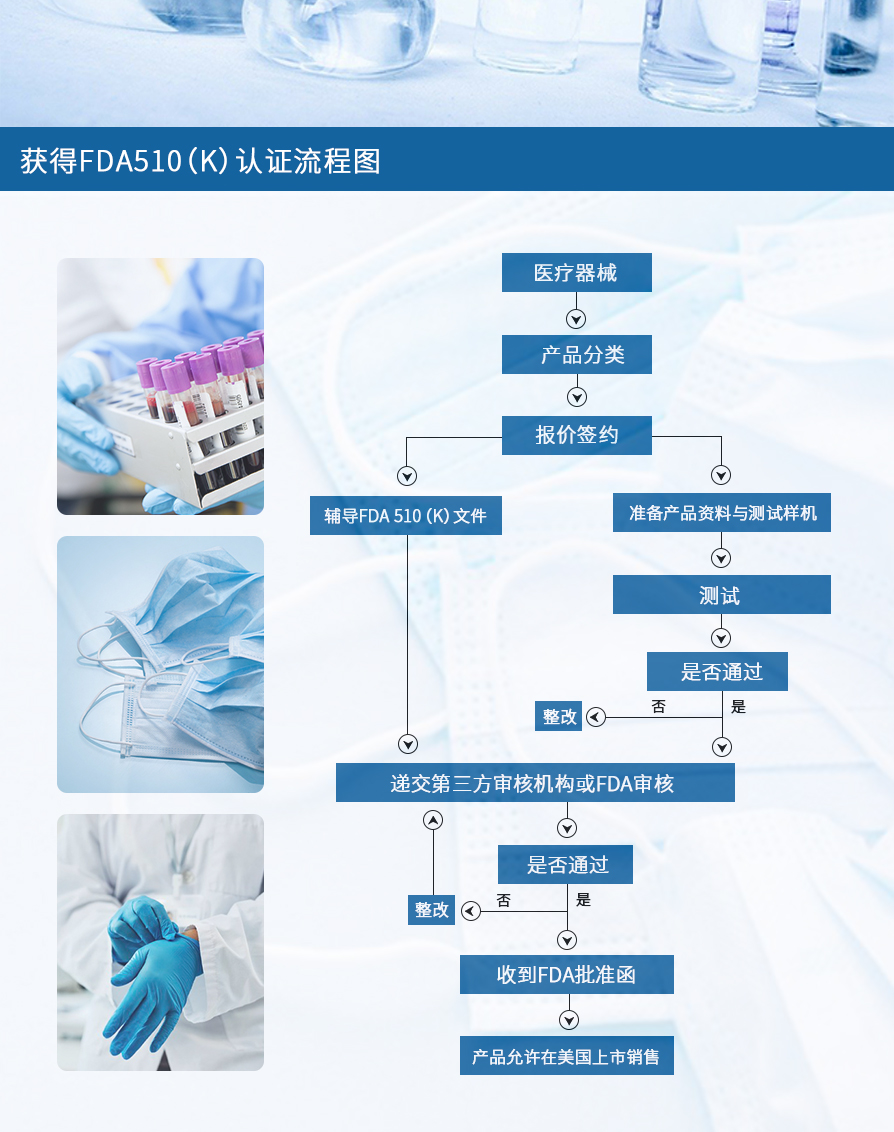
以上就是关于“FDA510(k)认证什么意思?”的相关内容,了解更多点击咨询。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务,咨询电话:400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








