欧盟医疗器械CE认证流程指南!
在许多医疗器械制造商中,普遍存在一个误解,那就是获得CE认证太难,太昂贵且太复杂。而在欧盟医疗器械CE认证流程指南中,我们将介绍其中的一些关键步骤,以便帮助企业快速获得医疗器械的CE标志。

医疗器械CE认证流程
第一步:分类
任何制造商的第一步都是要仔细检查他们的医疗器械。医疗设备打算做什么,以及如何实现此目的?此步骤的关键部分是确定欧盟指令和法规,它们可能对制造商的医疗器械产生的影响,并确保遵守其中的所有法规。重要的是要注意,此步骤的责任仅在于制造商。
第二步:识别
在对医疗器械进行分类并明确标出周围的指令后,下一步就是确定所有相关的欧洲统一标准和其他基本的健康与安全要求。在这一点上,确定是否需要获得CE标记的公告机构也很有用。
第三步:技术文件
为了获得CE标志,制造商必须完成并汇编必要的技术文档。这些可以包括但不限于医疗器械测试,评估,产品检查和相关审核。此后,制造商必须签发符合性声明。
在获得CE标志之前,所有类别的所有医疗设备都需要技术文件。技术文件是对适用指令的符合性和符合性的证明。技术文件的副本必须始终保存在欧盟内部,可应要求向任何欧盟主管部门提供。
第四步:任命欧洲授权代表(EAR)
根据欧盟医疗器械指令93/42 / EEF第14.2条:“没有在欧盟注册地址的制造商不得在欧盟市场上出售其医疗器械,除非他首先指定了授权代表[或EAR ]在欧洲联盟中。” 因此,所有在欧盟以外寻求医疗器械CE标志的制造商都必须任命欧洲授权代表(或EAR)。

欧盟授权代表
直连专家
第五步:认证
如果是I类产品,制造商将能够对医疗设备进行自我认证。对于上等产品,制造商需要与指定机构合作,后者需要对技术文档进行审核。如果您的产品属于上层阶级,并且您需要寻求认证机构来完成CE标记过程,则可以咨询海外顾问帮专家并使用他们的帮助来找到满足您所有需求的认证机构。
第六步:贴上CE标记
一旦医疗器械通过认证,制造商最终即可贴上CE标志。必须以清晰可见的方式在医疗器械和相关包装上粘贴医疗器械的CE标记以及EAR的详细信息。
第七步:国家规定
最后一步是符合国家要求为了将医疗器械引入几个欧盟国家(例如法国,希腊,意大利,拉脱维亚,葡萄牙),制造商必须在国家主管部门进行额外注册。
哪些国家和地区要求医疗器械具有CE认证?
欧盟成员国要求具有CE标记,但是欧盟成员国以外的一些国家已经采用了三个设备指令的要求。适用于医疗设备的国家/地区的最佳列表是主管当局的联系人列表。世界其他国家也认可CE认证。
医疗器械CE认证流程图
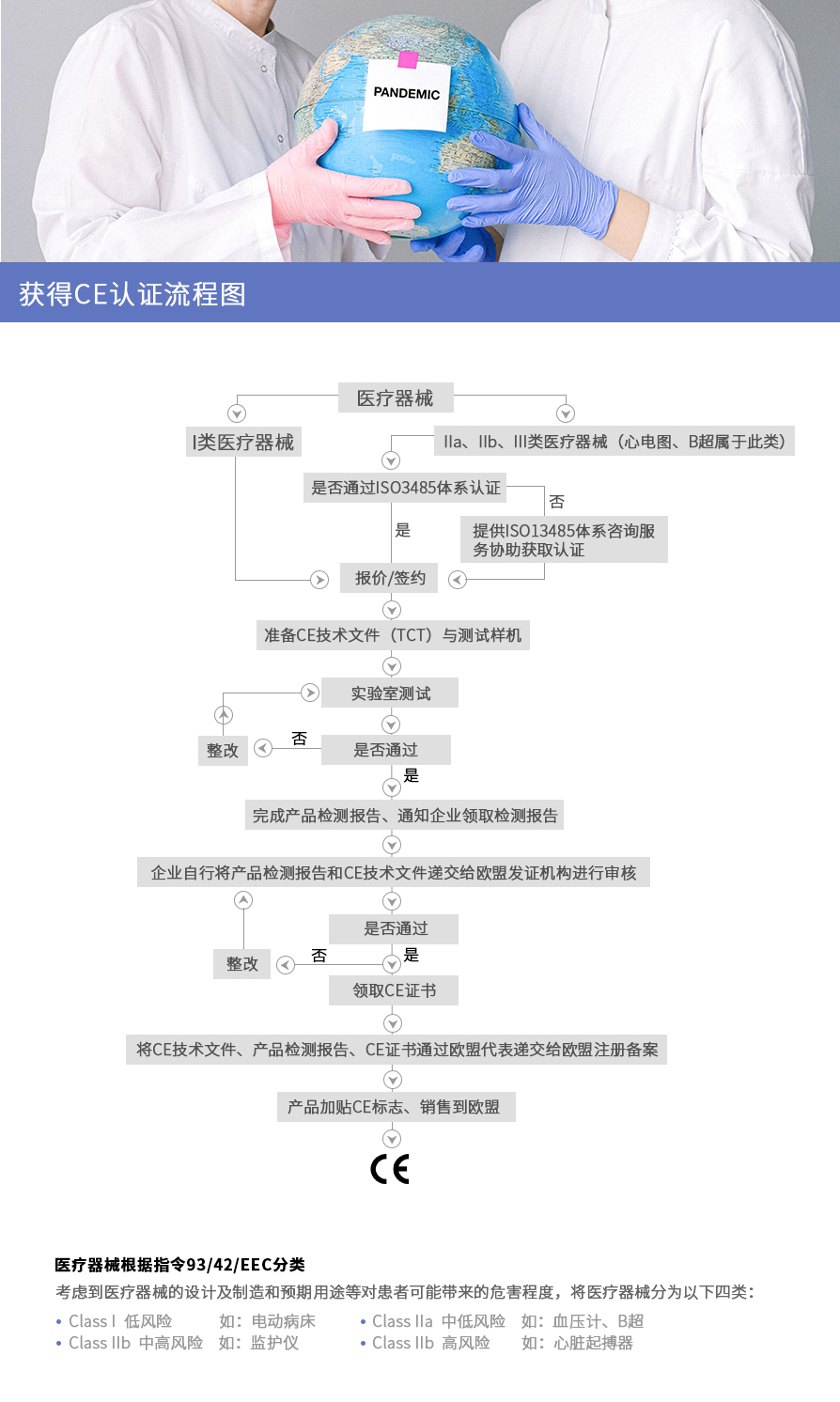
以上就是关于“欧盟医疗器械CE认证流程指南”的相关内容,了解更多点击咨询。
医疗器械只能在带有CE标志的欧洲销售。通过在产品上贴上CE标志,制造商声明其产品符合所有适用的《欧洲医疗器械法规》。作为全方位的医疗器械咨询公司,我们可以为您的I类,IIa类,IIb类或III类设备提供CE认证支持。

医疗产品CE认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








