关于美国FDA最新豁免510K政策的解读与建议
最近做手套出口美国的朋友们坐不住了,尤其是做丁腈手套的企业,因为FDA又出了新政策,到底是什么情况呢?原来,美国FDA相关部门在2021年1月15日发布了最新文章,如下图:

标题:通过免除某些医疗器械的上市前通知要求,在 COVID-19 公共卫生紧急事件期间提供永久的监管灵活性;要求获得有关 510(k)计划进一步科学和基于证据的改革的机会的信息,研究,分析和公众意见
概括:为了使美国人有更多机会使用某些医疗设备来应对COVID-19公共卫生突发事件,FDA发行了指导文件,提供了许多监管灵活性,包括根据食品,药品第510(k)节暂时放弃了上市前通知要求,和化妆品法。对于在PHE期间暂时取消510(k)售前审查的七种I类设备,卫生和公共服务部将永久免除510(k)要求的七(7)种I类设备,并且还建议豁免了510(k)要求中的其他83种II类设备和1种未分类设备类别,PHE期间也取消了售前审查。该部门正在招募公众
机构:(美国)卫生与公共服务部 食品与药品监督管理局
https://www.federalregister.gov/documents/2021/01/15/2021-00787/making-permanent-regulatory-flexibilities-provided-during-the-covid-19-public-health-emergency-by
该文指出以下 7 种 I 类产品可豁免 510(k) :
立即免除510(k)通知要求的I类设备
| 设备说明 |
设备类别 |
产品代码 |
21 CFR中的部分 |
| 无粉聚氯丁二烯患者检查手套 |
I |
OPC |
880.6250 |
| 病人检查手套,专业 |
I |
LZC |
880.6250 |
| 防辐射医用手套 |
I |
OPH |
880.6250 |
| 无粉非天然橡胶乳胶外科医生的手套 |
I |
OPA |
878.4460 |
| 无粉橡胶检查手套 |
I |
OIG |
880.6250 |
| 乳胶病人检查手套 |
I |
LYY |
880.6250 |
| 乙烯基患者检查手套 |
I |
LYZ |
880.6250 |
需要注意的是:这其中并不包含丁腈手套。因为丁腈手套的 CODE 为 LZA 。
但我们注意到:虽然已经发文对产品进行豁免,可截至目前(2021-3-1 上午 16 点)FDA 官网并没有将以上 7 款产品信息更新为豁免状态也即 510(k) Exempt 。最新查询结果如下:
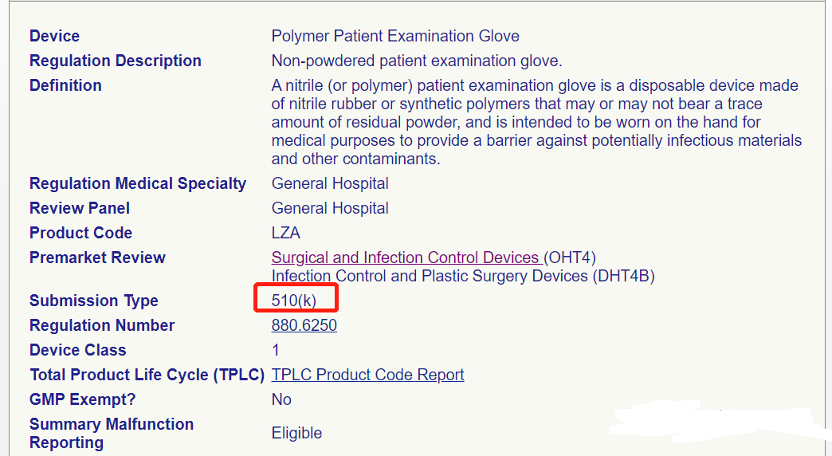
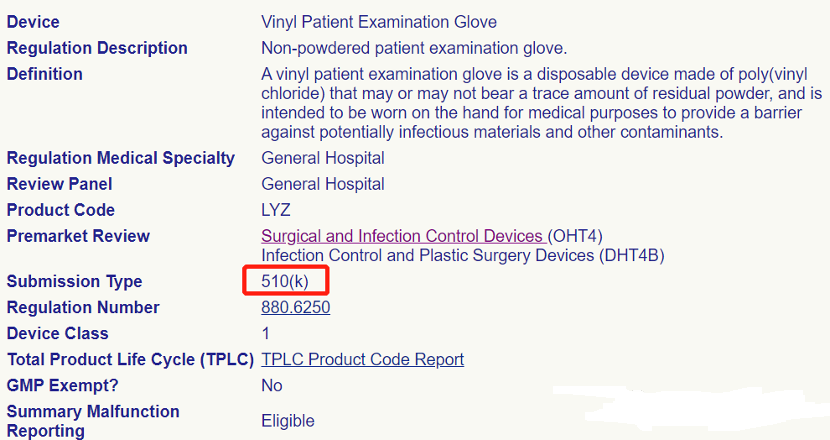
不仅如此,而且目前关于 LYZ 、LYY 等代码的 510K 申请受理一切如常,以下是在 1 月 15 号之后获取 K 号的申请企业:
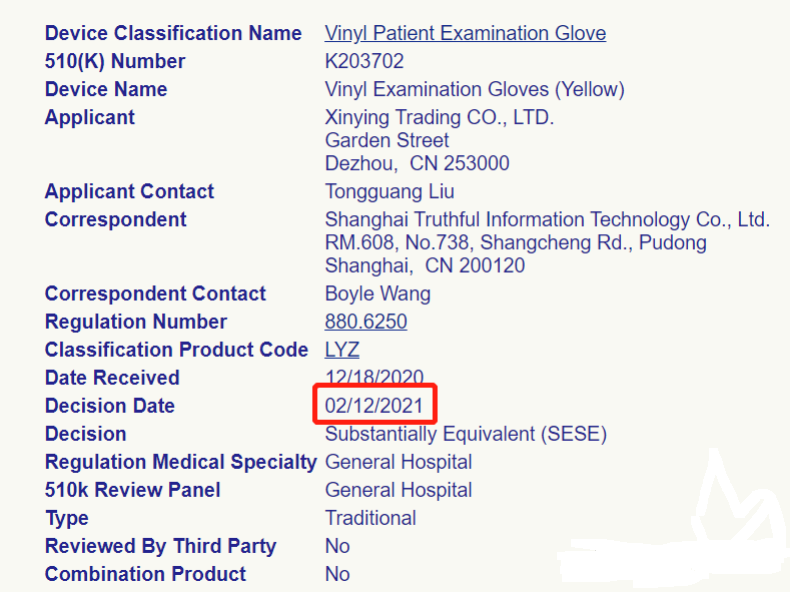
综上,针对 1 月 15 日 HHS 发布的内容,我们依据多年的 510K 申请经验总结如下:
您如果已经开始了 510K 的申请工作,建议工作继续进行,直至完成 510K 的批准;
您如果还未开始申请也可以继续等待 FDA 官方的信息,以查询到 FDA 中产品的分类信息变更为 510(k) Exempt 为准,但目前时间无法确定;
如果您有出口的需求,强烈建议您优先完成 FDA 关于 LYZ、LZA 等需求代码的 FDA 注册,因为在获得 510K 的审批后,也是需要进行 FDA 注册后才可以正常销售的。我司 3-5 个工作日即可完成 FDA 注册登记;
另外即使这些代码都豁免了,510K 仍建议您继续申请。因为其重要性和含金量不言而喻,况且 510K 申请成功后即再无任何费用,K号可一直持有。不管是公司上市、合并重组还是更名等,K号都是属于贵司的重要固定资产。
以上就是关于“关于美国FDA最新豁免510K政策的解读与建议”的相关内容,了解更多点击咨询。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








