医用口罩出口美国做FDA510(K)还是FDA注册?
受疫情的影响,口罩成为热销的贸易品。但是由于美国对进口产品的要求比较严格,所以很多口罩企业不知道医用口罩出口美国做FDA510(K)还是FDA注册?今天小编就给大家讲解下。
口罩在美国有两种注册方法,一种是I 类的普通口罩,属于510(K)豁免的产品,只需要要进行工厂注册和产品列名就可以了;另外就是常见的外科口罩(Surgical Mask),这种口罩在FDA 属于非510(K)豁免的产品,不仅要进行工厂注册和产品列名,还要编写FDA510(K)文件,提交FDA 审核,审核通过后才可进入美国市场。
去年3月和4月期间,美国FDA就口罩产品发布了多个EUA路径,以扩充疫情期间口罩的供应能力。EUA覆盖的产品包括了非外科医用口罩、KN95口罩和N95口罩。对于外科口罩在Enforcement Policy中有相应的方针性的表述,在满足一定的使用限制和测试标准的前提下,没有510(K)也不会被FDA拒绝。但是从前段时间KN95口罩通过EUA模式申请出口的情况来看,其资质是临时性而且不稳定。那么,如果要获得稳定的出口资质,对于医用外科口罩最可靠的路径还是申报510(K)。
Part.1 近三年美国FDA批准的外科手术口罩
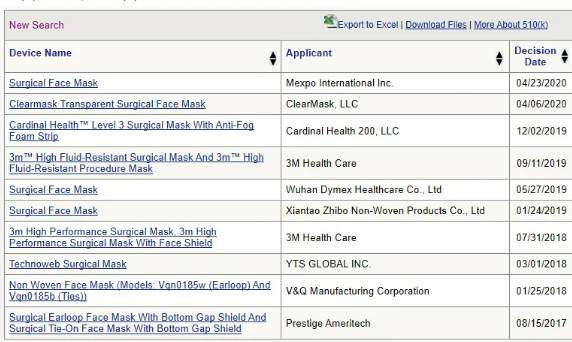
图1
我们查询了FDA官网,了解到近三年美国FDA仅批准了10个外科手术口罩的注册(510K)申请,其中有2家企业是中国制造商(详见图1)。这两家中国制造商分别是Wuhan Dymex Healthcare Co., Ltd. 和 Xiantao Zhibo Non-Woven Products Co., Ltd.。
Part.2 美国FDA对于医用外科口罩的技术要求

医用外科口罩看似很简单,主要构成部件包括口罩主体,鼻梁条,耳挂。其中口罩主体一般由三层构成,分别是外层无纺布、里层无纺布以及中间的过滤层。过滤层通常用熔喷布材料制成。
那么,美国FDA对于医用外科口罩的技术要求有哪些呢?
通常包括两大方面,一个是产品本身的各种过滤和防护性能。另一方面就是所有的材料的生物相容性。
1)产品过滤和防护性能
- 防液体喷溅穿透能力;
- 微粒过滤效率PFE;
- 细菌过滤效率BFE;
- 呼吸阻抗Delta P测试;
- 易燃性指标。
2)材料的生物相容性
生物相容性是材料安全性的关键指标,通常和人体完好皮肤接触的产品仅需要测试细胞毒性、致敏和皮肤刺激三个指标。但是对于口罩各个不同结构部分,由于其材料不一样,有无纺布、有橡筋耳挂,有塑料或金属鼻梁条,都需要分开测试以提供安全性的证据。如果口罩的颜色不一样,生物相容性测试也需要分开进行,因为不同的色素可能会导致不一样的生物相容性。
上述就是美国FDA对于医用外科口罩的主要技术要求,当然还包括诸如产品的外观、尺寸以及灭菌状态和标签的要求等。
Part.3 美国FDA 510(K)申报流程
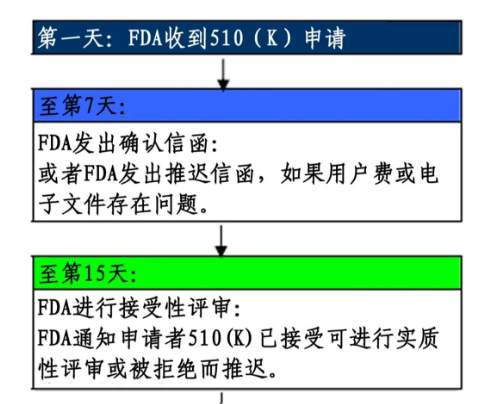
1)美国FDA的审批流程示意图
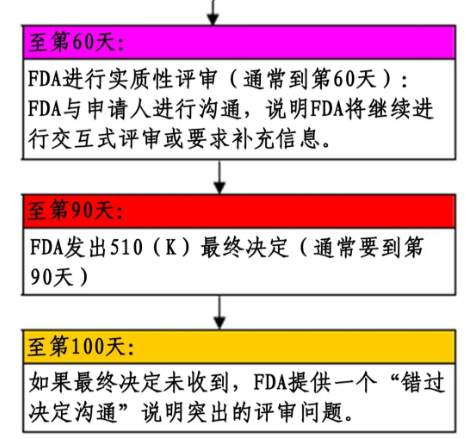
2)海外顾问帮提供FDA 510(K)服务全流程示意图
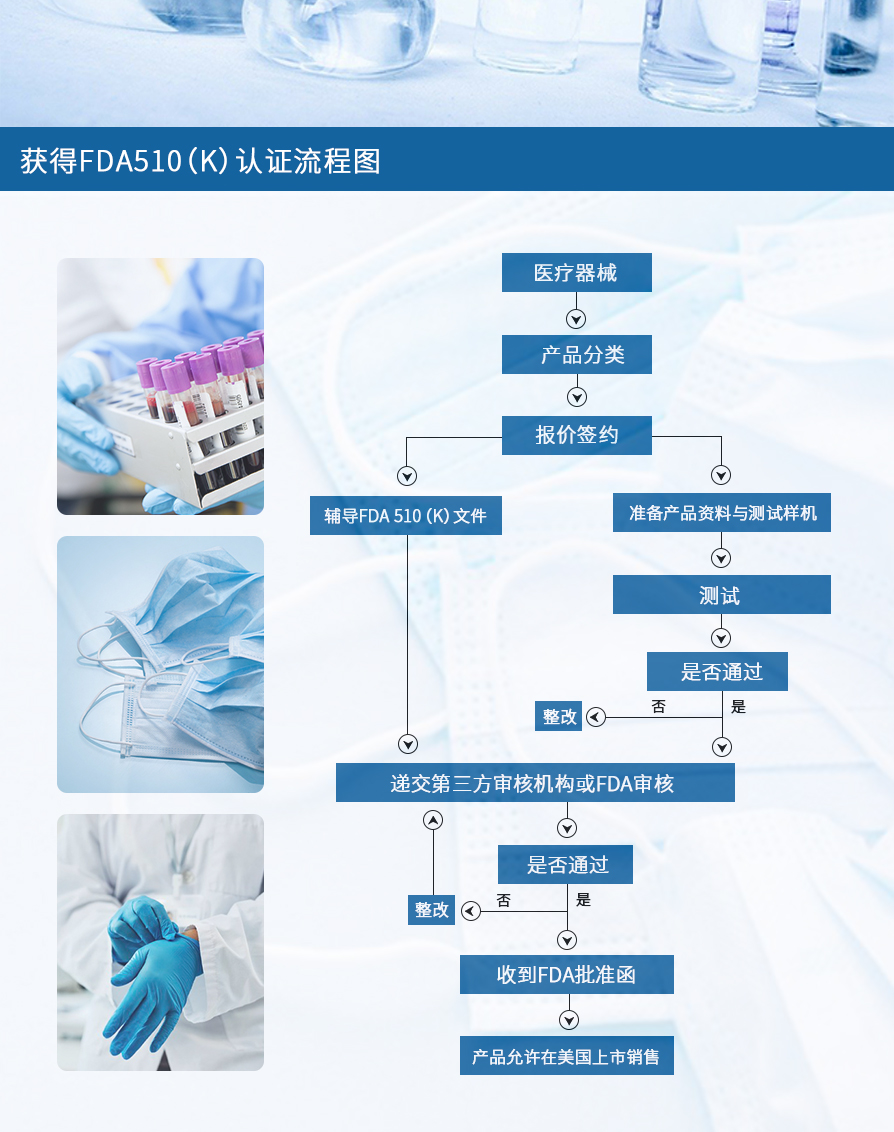
FDA 510(K)批准不会过期,资质不需要缴费维护;
在开展申报过程中,由于测试的要求严格,其报告通常还适用于其他市场。通常生物学报告可以用于国内的注册申报,性能测试报告可以用于其他国际市场;
FDA 510(K)批准信息会纳入美国FDA官方数据库,在FDA官网公开可查。
所以,如果希望你的口罩能长期稳定出口美国市场,那么FDA 510(K)才是最靠谱的证件。如果您想办理医用口罩FDA 510(K)可以点击咨询。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务,咨询电话:400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








