欧盟医疗器械CE分类规则以及认证流程
如果你是一个制造商,并且想要把你的医疗设备投放到欧盟市场上,你需要确保它符合欧盟委员会规定的具体欧洲指令。在这种情况下,重要的是医疗器械指令(MDD):AIMDD 90/385/EEC;MDD 93/42/EEC;IVDMDD 98/79/EC。
为了证明您的设备符合这些CE指令的基本要求,您需要在产品上贴上CE标志。为此,您的产品需要经过CE标记过程。后者的方向取决于您的医疗器械类别和您对合格评定路线的选择。医疗设备的具体特性将决定其类别,并分别决定其对患者的风险。例如,诸如预期用途、侵袭性和局部与全身效应等特征。
根据欧洲框架,医疗设备分为四类:I,IIa,IIb和III类。第三类医疗器械风险最高。如今,由于新法规系统的严格规定,许多设备的类别都发生了变化。在将它们放置在IIa或IIb类之前,但现在将它们放置在III类中。如果您的医疗设备属于I类以外的其他任何类别,则您必须向认证机构提供证明,证明您的产品符合相应CE指令的基本要求。继续阅读以了解有关每个课程的更多信息,以及需要通过哪些步骤才能通过CE标志医疗器械。
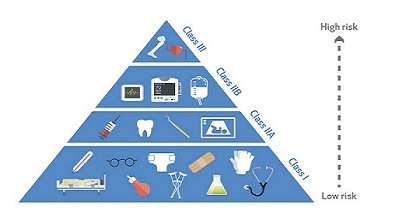
I类医疗器械
第一类医疗设备的感知风险最低。这种设备的制造商可以从三种可能的CE标记途径中选择一种。在这方面,他们应考虑以下内容:医疗设备是否无菌,例如个人防护套件;医疗设备是否具有测量功能,例如听诊器;如果不是无菌的,也不能测量例如矫正眼镜。如果您的产品属于I类,并且不是无菌或测量设备,那么您所要做的就是自我认证,并通过书面声明正式声明其符合MDD的适用要求。如果它是无菌的或可测量的医疗设备,那么您将需要经过公告的身体评估。
表1:I类医疗设备的CE标记路线
| 无菌医疗器械 | 测量医疗器械 | 其他医疗设备 |
| 1. 编制支持符合性声明的技术文件 2. 公告机构对产品制造过程中有关无菌条件的调整和保持的评估 3. 将公告机构的注册号放置在CE标志旁边 4. 在产品上贴CE标志,并保存符合性声明和主管部门检验的证明材料 5. 将医疗器械投放市场 |
1. 编制支持符合性声明的技术文件 2. 认证机构对符合计量要求的产品进行合格评定 3. 编写符合性声明 4. 向主管当局登记 5. 在产品上贴CE标志,并保存符合性声明和主管部门检验的证明材料 6. 将医疗器械投放市场 |
1.编制支持符合性声明的技术文件 2.编写符合性声明 3. 向主管当局登记 4. 在产品上贴CE标志,并保存符合性声明和主管部门检验的证明材料 5. 将医疗器械投放市场 |
IIa类医疗设备
IIa类的医疗设备可能是手术手套,助听器,超声诊断仪等,它们通常构成中低风险。患者应在短于30天的短期内使用它们。如果您是IIa级医疗设备的制造商,则必须备份符合声明的人体评估声明。只有这样,您才可以将您的产品投放市场。有四种可能的CE标志产品的途径,根据产品的类型(即是否经过消毒)分为两组。
表2. IIa类医疗设备的CE标记路线
| 所有医疗设备 | 仅限非无菌医疗器械 | ||
| 方法1 | 方法2 | 方法1 | 方法2 |
| 1. 由公告机构进行全面质量保证审核 2. 创建符合性声明 3. 在产品上粘贴CE标志和公告机构编号 4. 将医疗器械投放市场 |
1. 编制支持符合性声明的技术文件 2. 由公告机构进行的生产质量保证审核 3. 创建符合性声明 4. 在产品上粘贴CE标志和公告机构编号 5. 将医疗器械投放市场 |
1. 编制支持符合性声明的技术文件 2. 由公告机构进行的检验质量保证审核(不包括设计和制造) 3. 创建符合性声明 4. 在产品上粘贴CE标志和公告机构编号 5. 将医疗器械投放市场 |
1. 编制支持符合性声明的技术文件 2. 通知机构需要验证每个设备/批次 3. 创建符合性声明 4. 在产品上粘贴CE标志和公告机构编号 5. 将医疗器械投放市场 |
IIb类医疗设备
在这里,我们可以包括医疗设备,例如长期矫正隐形眼镜,手术激光,除颤器等。它们是中到高风险的设备,患者可能会使用30天以上。如果您的产品属于IIb类(类似于IIa类中的程序),则您将需要一个指定机构来评估您的技术文档,以确保其符合《医疗器械指令》的要求。特定CE标记路线的选择将再次取决于您产品的类型。
表3. IIb类医疗设备的CE标记路线
| 所有医疗设备 | 仅限非无菌医疗器械 | ||
| Route1 | Route 2 | Route 1 | Route 2 |
| 1.Full quality assurance audit by a notified body 2.Creating a Declaration of Conformity 3.Affixing the CE mark and notified body number on the product 4. Placing the medical device on the market |
1. Type examination by a notified body 2. Production quality assurance audit by a notified body 3. Creating a Declaration of Conformity 4. Affixing the CE mark and notified body number on the product 5. Placing the medical device on the market |
1. Type examination by a notified body |
1. Type examination by a notified body 2. A notified body needs to verify every device/batch 3. Creating a Declaration of conformity 4. Affixing the CE mark and notified body number on the product 5. Placing the medical device on the market |
III类医疗设备
在该类别中,所有医疗设备均具有最高的风险,因此在其生命周期内需要进行永久监控。有专门机构负责产品的监控。这样的装置例如是心血管导管,动脉瘤夹,髋关节植入物,人工心脏瓣膜等。在这里,以及在第II类中,医疗器械的合格评定可能包括对技术文档和质量体系/产品检查的审核,并将重点放在器械设计和生产的一个或多个方面。
表4. III类医疗设备的CE标记路线
| All Mecical Devices | Only Non-Sterile Medical Devices | ||
| 方法1 | 方法2 | 方法1 | 方法2 |
| 1. 由公告机构进行全面质量保证审核 2. 创建符合性声明 3. 在产品上粘贴CE标志和公告机构编号 4. 将医疗器械投放市场 |
1. 由公告机构进行的设计档案检查 2. 创建符合性声明 3. 在产品上粘贴CE标志和公告机构编号 4. 将医疗器械投放市场 |
1. 由公告机构进行型式检验 2. 由公告机构进行的生产质量保证审核(不包括设计) 3. 创建符合性声明 4. 在产品上粘贴CE标志和公告机构编号 5. 将医疗器械投放市场 |
1. 由公告机构进行型式检验 2. 通知机构需要验证每个设备/批次 3. 创建符合性声明 4. 在产品上粘贴CE标志和公告机构编号 5. 将医疗器械投放市场 |
以上就是关于”欧盟医疗器械ce分类规则以及认证流程“ 的相关内容,了解更多点击咨询。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为医疗产品CE认证提供一站式服务,咨询电话:400-106-2206。

医疗产品CE认证
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








