EC关于唯一设备标识系统
欧盟医疗器械领域的监管机构欧盟委员会 (EC) 发布了详细的常见问题解答,专门针对与根据医疗器械法规 2017/745 (MDR) 建立的唯一器械标识 (UDI) 系统相关的最重要问题) 和体外诊断医疗器械法规 2017/746 (IVDR)。

UDI 监管背景
EC 描述了医疗器械领域的一般监管背景。根据该文件,如今医疗器械受到一系列指令的监管,包括:
- 医疗器械指令,
- 体外诊断医疗器械指令,
- 有源植入设备指令。
同时,这些指令后来将被法规(MDR 和 IVDR)取代。由于种种原因,《条例》的实际实施被推迟。截至今天,MDR 和 IVDR 的计划实施日期分别为 2021 年 5 月 26 日和 2022 年 5 月 26 日。
根据上述规定,将引入医疗器械专用标识系统。新系统旨在提高投放市场的医疗器械的可追溯性,并使上市后活动更加有效。这对监管当局也很有用——这样的系统将简化监督和控制。UDI 系统可用于识别伪造设备。参与医疗器械运营的所有各方也可以使用它来改善其库存管理。
新引入的 UDI 制度的范围涵盖了所有类型的医疗器械,但有一定的排除,即:
- 定制的医疗器械(由实验室或医疗机构自己设计和制造的供内部使用的器械),
- 性能研究和研究设备(不打算销售的设备)。
唯一的设备识别系统基于国际公认的原则,并以确保与欧盟成员国的国家立法尽可能高的兼容性的方式开发。
根据条例的适当规定,UDI系统包括:
- 包含 UDI 设备标识符 (UDI-DI) 的 UDI 制造,该标识符应特定于特定设备及其制造商,以及用于识别特定单元的 UDI 生产标识符 (UDI-PI)。
- 将 UDI(UDI 载体)放置在标签或包装上。对于可重复使用的医疗设备,可以使用直接标记方法——在这种情况下,UDI 载体将放置在设备本身上。
- 根据条例规定,参与医疗器械运营的各方对 UDI 的存储,
- 作为欧盟范围内的医疗器械数据库 - EUDAMED 的一部分,实施特殊的 UDI 数据库。
因此,该条例规定,除不需要的情况外,医疗器械制造商应在器械的标签和/或其包装之前将 UDI 放在器械的标签和/或其包装上,但不需要的情况除外,并确保已上传所有必要的信息。并在 EUDAMED 中提供。
值得一提的是,为了获准在欧盟销售其医疗器械,制造商还必须分配和放置基本 UDI-DI——一种用于访问与器械相关的信息的特殊标识元素存储在数据库中。
独特的设备识别系统:关键点
本 EC 常见问题解答为所有参与医疗器械运营的各方提供了与正确使用 UDI 相关的最重要方面的其他详细信息和说明。
根据该文件,UDI 包括根据全球公认标准应用的数字或字母数字字符,使它们能够识别特定的医疗设备。每个 UDI 包含 UDI-DI 和 UDI-PI。
UDI 系统的主要元素之一是基本 UDI-DI – 它在所有文档中都有说明,因此可用于访问所有特定于设备的信息。它还可用于识别在基于风险的分类下具有相同预期用途或类别的医疗器械。值得一提的是,它与设备的标签或包装分开使用。

医疗产品CE认证
医疗器械制造商的义务
EC 强调,医疗器械制造商应全权负责实现和保持遵守与唯一器械标识符的分配和使用相关的适用要求。具体来说,制造商的责任范围包括以下几个方面:
- UDI(基本UDI-DI)的分配,
- UDI在欧洲医疗器械数据库中的注册,
- 将 UDI 载体放置在设备标签、包装或设备本身上。
值得一提的是,任何履行制造商义务的实体都应对 UDI 系统的正确应用负责。同时,医疗器械的供应商和进口商也有特定的义务,即:
- 他们应该确保 UDI 保持清晰可见和可读,
- 他们应该实施 UDI 相关程序作为内部质量管理体系的一部分。
因此,在欧盟销售之前,任何和所有医疗器械都应分配有基本 UDI-DI。适当的信息也应上传到 EUDAMED。
UDI 要求申请
根据欧盟关于 UDI 系统的常见问题解答,适当的要求将与上述法规的实际实施一起生效:分别于 2021 年 5 月 26 日对 MDR 和 2022 年 5 月 26 日对 IVDR 生效。同时,负责医疗器械的实体将有更多时间将器械相关信息上传至 EUDAMED。特别是,该文件规定了以下条款:
- 2023 年 11 月 26 日,适用于受 MDR 监管的经典医疗器械,以及
- 2023 年 11 月 26 日,适用于受 IVDR 监管的体外诊断医疗器械。
但是,如果当时 EUDAMED 功能齐全,则上述条款将适用。欧盟委员会承认 EUDAMED 发射可能面临某些延迟。在这种情况下,应在 EUDAMED 完全发挥功能之日起 24 个月内提供特定于设备的信息。值得一提的是,由于在 EUDAMED 中存储信息所采用的原则,只有在有关医疗器械的一般信息已经上传到数据库的情况下,才能注册有关可能的不良事件的详细信息。
欧盟委员会还根据基于风险的分类下的医疗器械类别提供了实施时间表。根据时间表,应在以下条款内应用特定要求:
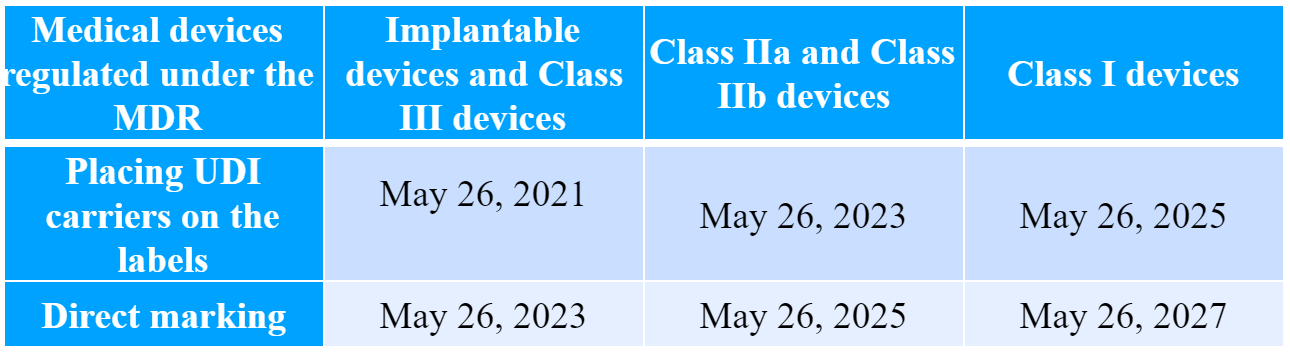
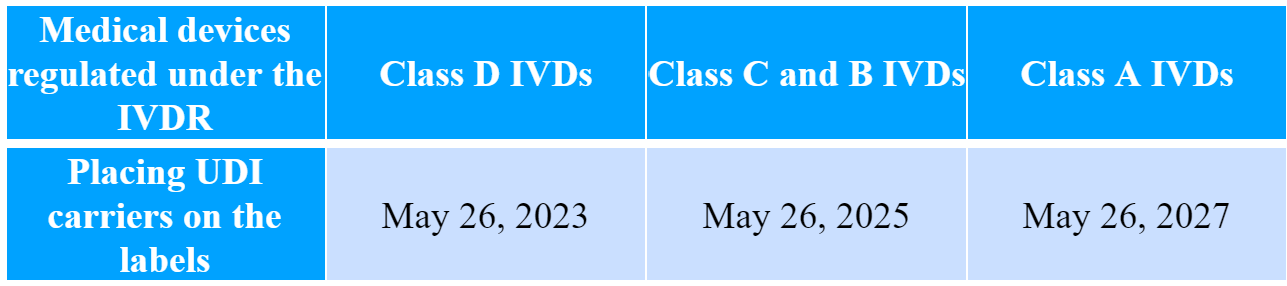
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








