欧盟MDR法规下必须了解的10个医疗器械符号
欧盟MDR法规下必须了解的10个医疗器械符号
医疗器械法规 (MDR) 2017/745 提出了更严格的新要求,要求在医疗器械标签上注明各种信息。为了以统一的方式快速遵守这些要求,医疗器械制造商可以使用目前关于医疗器械符号的指南。
为什么在医疗器械标签上使用符号?
欧洲有 20 多种官方语言,因此有必要将标签信息翻译成多种语言,具体取决于医疗器械的销售地点。使用符号可以很容易地处理这样的要求。幸运的是,对于 MedTech 制造商而言,新 MDR 法规允许在医疗器械标签上使用符号代替书面语言:附件 1,第三章,第 23.1 条。
符号是有效且国际公认的概念,允许向医疗设备用户传达所需的信息。医疗器械标签的所有符号部分必须易于识别且高度至少为 5 毫米。必须在特定医疗设备随附的使用说明中描述一个或多个特殊符号的使用。
特殊医疗器械符号
所有医疗器械标签要求均在 MDR 2017/745 附录 I 第三章、第三章中描述。它们概述了医疗器械标签上必须包含的内容,并作为下述符号的立法参考。
1. 医疗器械:该符号表示制造商打算用于人类特定医疗目的的产品,例如诊断、预防、监测、治疗或缓解疾病。

2. 含有人体血液或血浆衍生物的医疗器械

3. 含有药用物质的产品

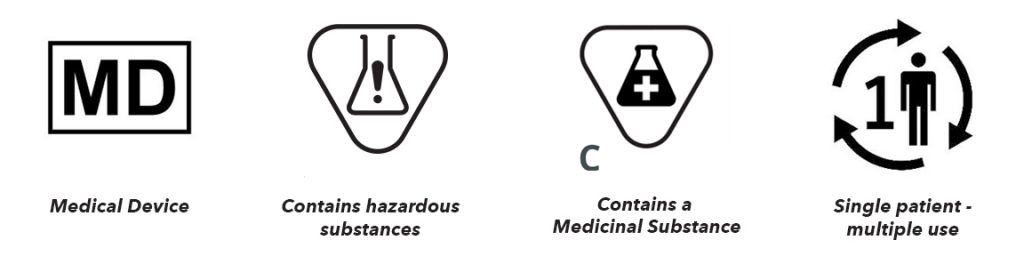
4. 含有有害物质的医疗器械:该符号表示含有致癌、致突变、生殖毒性或内分泌干扰物质的医疗器械。
5. 含有人体生物材料(例如组织、细胞或其衍生物)的医疗器械

6. 含有动物源性生物材料(例如组织、细胞或其衍生物)的医疗器械

7. 在无菌条件下提供的医疗器械:制造商还必须指定灭菌方法。

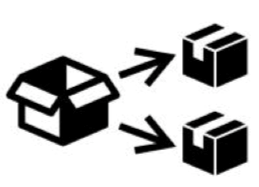
8. 翻译和重新包装符号:合法制造商以外的经济经营者必须在医疗器械上或在不可行的情况下,在其包装或使用说明书上注明所开展的活动及其名称、注册商标、注册营业地以及可以联系到他们的地址。

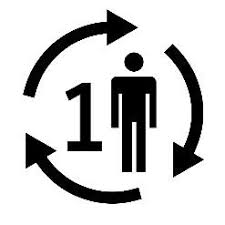
9. 表示“单个患者 – 多次使用”的符号,如果医疗器械仅供一次性使用、可在单个患者身上重复使用和/或在多个患者身上重复使用。
10. UDI 符号:该符号不是强制性的,但当医疗器械标签上存在多个数据载体时必须使用该符号。

以上就是关于“欧盟MDR法规下必须了解的10个医疗器械符号”的相关内容,了解更多点击咨询。

欧盟CE认证
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








