FDA 510k申请流程要求以及申请周期是多久?
随着新冠疫情日益的增加,口罩等防护物品出口的需求量越来越大,但是要想把产品出口到美国,必须要做FDA认证,很多人也问我们有必要做FDA吗?510K申请都有哪些要求?申请周期是多久?今天我们就来一起说一说。

如何做FDA 510K?
一次性口罩I类医疗器械产品,对于I类豁免510K的医疗器械,做FDA注册相对比较简单,只要提供申请人信息(包括公司名称、地址、电话、联系人、邮箱、网站等)和产品英文名称即可,要是能多提供一些产品信息自然更好。
FDA510K医疗器械范围,如电子血压计,电子体温计、雾化器、ECG心电图仪、电动轮椅、肌肉刺激仪、微导管导丝产品等注册FDA510K,需要准备所有提交报告的文档报告要求工厂必须按照要求的各部分文档信息提交相应的报告,为了工厂更详细了解对于某种特定的产品要申请FDA510K的测试报告以及文档要求,FDA制定了一些详细的Guidance,即510K指南。

FDA 510K产品申请要求
以电子临床体温计为例:上市前通知内容指南FDA510(K)临床电子温度计的提交资料
1. 介绍性信息
1)本文件规定了510(K)临床审查要求。电子温度计。此通用类型中的设备示例包括测量口腔、腋窝、直肠或鼓室的装置。使用多种方法的温度。温度计可以或不可以包括单独的一次性探头盖。除外责任本指南不涉及临床汞的提交。温度计或临床变色温度计(如21CFR中所述分别为880.2900和880.2920)
2)本指南旨在:
- 协助人员(制造商、经销商或进口商)组织上市前通知临床电子温度计;
- 满足要求和提供信息;
- 指导FDA审查人员进行临床上市前通知回顾
3)定义
- 临床电子体温计:见FDA880.2910号法规,作为“用于测量利用传感器测量病人体温加上电子信号放大,空调和显示单元。传感器可能在可拆卸探针中,无论有无一次性封面。”
- 准确度:测量值从装置与测量的“真”值一致。通过其他标准装置,如热电偶根据NIST标准或其他标准校准的装置公认的国家标准。
- 探头:一个组件,包括传感器,用于将传感器定位在特定位置确定温度。
- 辐射温度计:用来测量基于辐射的目标身体部位温度从目标部位(如红外鼓室)发射温度计)。
- 传感器:提供可测量的作为温度函数的输出(如电阻)。
- 精度:温度达到的程度测量和表示。
- 预期用途:人的客观意图对设备的标签负有法律责任。这个意图由他们的表达决定,或者由分布周围的环境显示设备的。
FDA 510K注册流程图
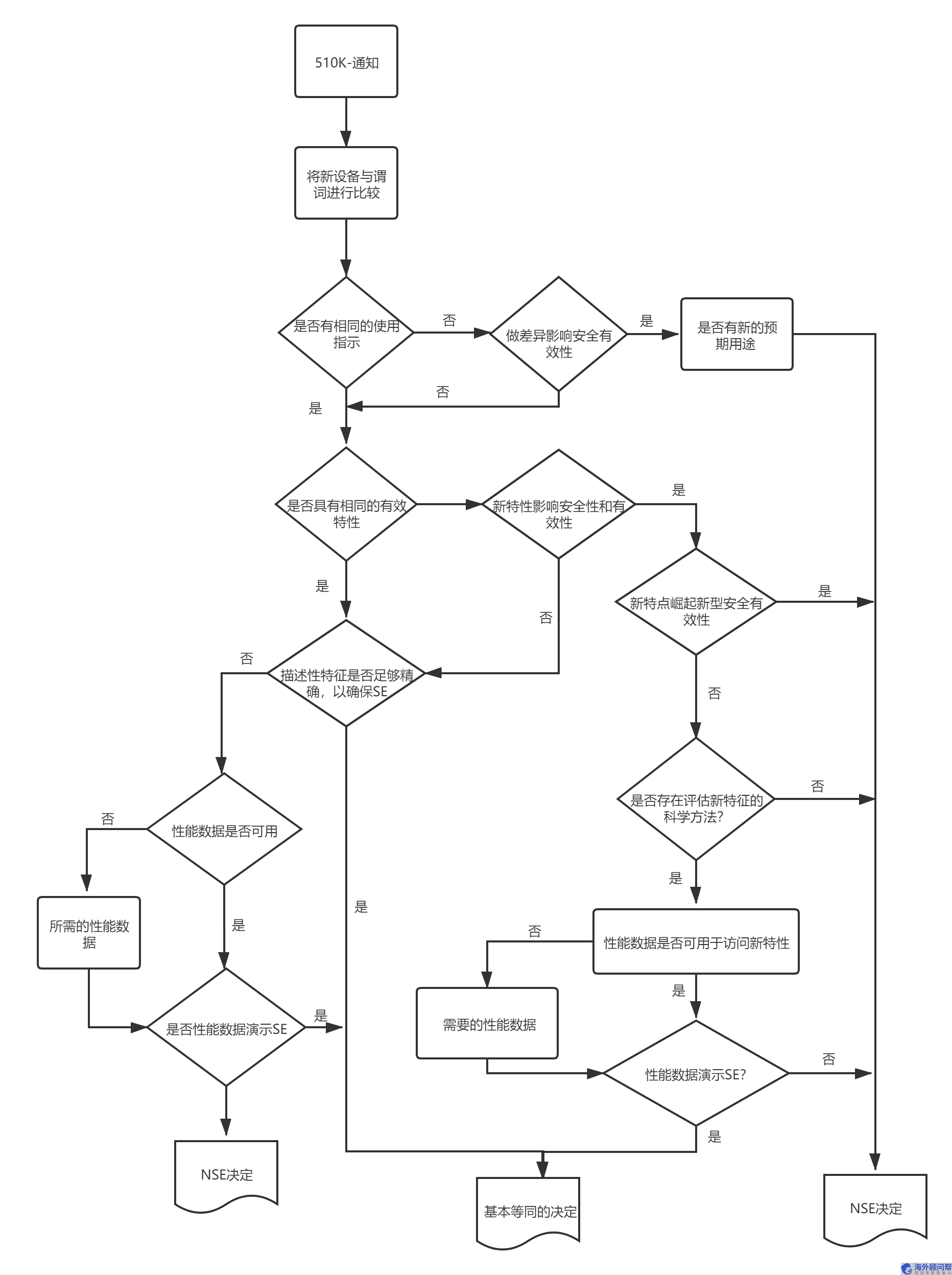
FDA 510K注册申请周期
根据产品的类别来确定,一般I类产品,并且是豁免510K的话,这种比较快,15个工作日内就可以完成产品注册,在2009年10月份之前,3-5个工作日就可以取得注册码,2009年10月份以后,必须先支付美国年金费用,才能得到注册码,所以在支付费用的环节上,比原来严格了一点,以前是先给注册码,后支付费用,现在是先支付费用,后给注册码。这样的话,周期就延长了一点。如果不是豁免510K的产品,那么做510K的时间相对比较长,这个还要看客户选择哪个认证机构来审核510K报告,如果选择第三方机构来审核,时间相对快一点,一般3个月内基本可以拿到510K号码,如果选择FDA直接来审核,那就慢了,没有10个月基本都不可能。
以上就是关于“FDA 510k申请流程要求以及申请周期是多久?”的相关问题,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展的一站式服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务,详情请咨询官方电话:400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








