澳大利亚TGA医疗器械注册流程及注意事项
近年来,我国与澳大利亚的贸易量逐渐增多,贸易全球化的热潮正一步步升温。2020年新冠肺炎的蔓延,如何向世界出口医疗器械也成为令制造商们头疼的问题,下面我们介绍一下澳大利亚TGA医疗器械注册流程及注意事项。

1.什么是TGA?
澳大利亚药物管理局(therapeutic goods administration),简称TGA,是澳洲卫生部所属的联邦药物主观机构(相当于我国视频药品监督管理局),通过采用一系列的监管措施,确保澳洲公众能够及时获得所需药品,并且保证这些药品符合相关的标准。
2.对医疗器械管理的目标及流程
基本原则
1、使用医疗器械不能损害人体健康和安全;保证长期安全;
2、医疗器械的设计和制造需符合安全原则;具有辐射防护;
3、化学、物理、生物学特性;制造及环境特性;
4、具有测量功能;连接或装备由能源的医疗器械;
5、临床证明;提供有关医疗器械的信息;

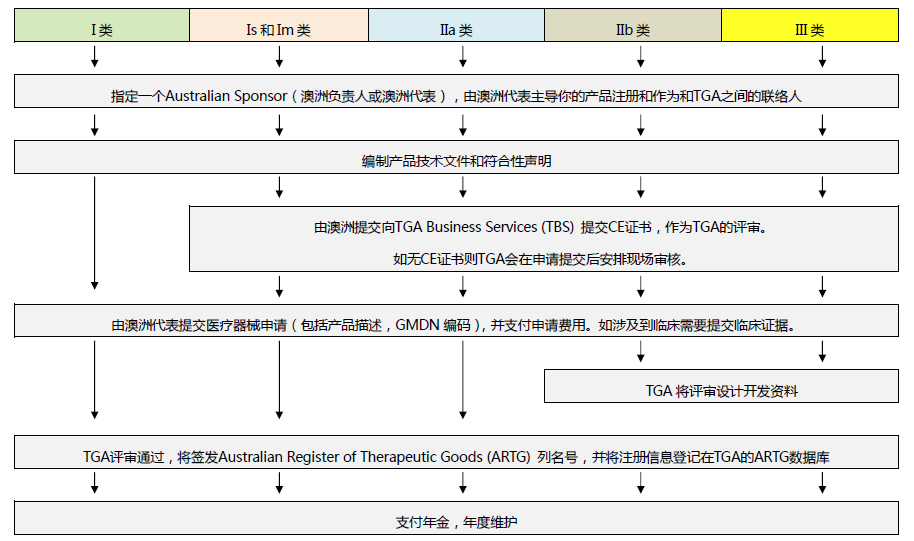
澳大利亚TGA医疗器械注册流程
1、确认产品在TGA属性及分类(可参考CE分类);
2、签订澳洲代理人服务协议;协助企业填写申请表
3、收集产品CE证书及CE技术资料(I*及以上产品适用);
4、联络TGA,递交注册资料,编制TGA注册的产品符合性文件,并提交TGA审核(I*及以上产品适用)
5、完成TGA注册
3.澳大利亚TGA医疗器械注册注意事项
1、TGA认证通过后,可以申请产品在澳大利亚的注册,也可以接受这些国家或者在这些国家注册公司的委托生产;
2、TGA对证书的有效期不是统一的,有时定为3年,有时定为2年,而且在有效期内任何时候都可以来复检;
以上就是澳大利亚TGA医疗器械注册流程及注意事项的一些基本知识,了解更多请咨询【海外顾问帮】。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为海外提供一站式服务,咨询电话:400-106-2206。

澳大利亚TGA代理人
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








