秒懂!I 类医疗器械的CE认证流程图
什么是I类医疗器械?
I类医疗器械是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械。如:外科用手术器械(刀、剪、钳、镊、钩)、刮痧板、医用X光胶片、手术衣、手术帽、检查手套、纱布绷带、引流袋等。
I类医疗器械的CE认证步骤:
- 分类:确认产品属于I类医疗器械
- 选择符合性评估途径:请参考下面的流程图
- 编制技术文件
- CE符合性声明
- 委任欧盟授权代表
- 由欧盟授权代表将制造商及产品在欧盟主管机关注册
- 建立售后警戒系统/加贴CE标签并将产品投放市场
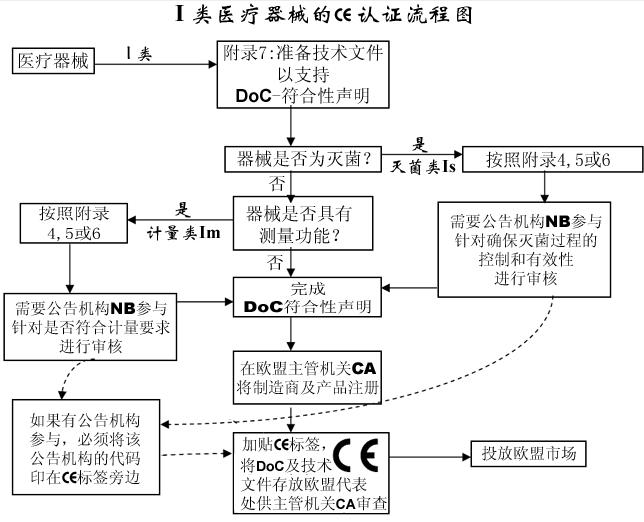
I 类医疗器械的CE认证流程图
I类医疗器械: CE 符合性评估途径
- 制造商有责任确保其产品符合93/42/eec指令的所有相关的基本要求,必须制定一份书面(自我)声明来保证。
- 不具备测量功能或非灭菌的I类医疗器械(的CE认证过程中)不需要第三方公告机构(NB)参与。是否符合ISO13485:2003标准,由制造商自愿选择,并非强制性。
- 具有测量功能或灭菌类的I类医疗器械(的CE认证过程中)必须要有第三方公告机构(NB)参与。
- 一旦制造商认为其产品符合93/42/eec指令的所有相关的基本要求,(欧盟境内的)制造商,或者(欧盟境外制造商的)欧盟授权代表必须先在欧盟主管机关注册,然后才可加贴CE标签并将产品投放EEA市场。

以上就是关于“I 类医疗器械的CE认证流程” 的相关内容,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展的一站式服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为CE认证提供一站式服务,详情请咨询官方电话:400-106-2206。
(文章部分图片来源于网络,如有侵权请联系删除)
版权声明:本站内容源自互联网,如有内容侵犯了你的权益,请联系删除相关内容。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








