医用口罩出口美国有哪些要求?
随着全球新型冠状病毒肺炎疫情风险升级,口罩等防疫物资一度出现告急,尤其是在欧美国家。在此情况下,口罩商机很快将转移到国外。那么医用口罩出口美国有哪些要求?

美国医用口罩简介
口罩按其预期用途可以分为:个人防护口罩和医用口罩两大类别,在欧美依据不同的法规在管理。美国对于医用口罩的管理机构是FDA,在FDA系统中对于口罩的分类代码有如下3个。其中一个是外科口罩,一个是儿科口罩,一个是带有抗菌/抗病毒介质的外科口罩,如下图所示。

美国FDA分类数据库中的口罩
三个类别的口罩都属于规则878.4040,分类都是II类,都需要申请510K批准。那么我们正常出口美国的口罩必须的路径为:
- 进行产品测试(性能测试、生物学测试)
- 准备510K文件,提交FDA评审
- FDA发510K批准信
- 完成工厂注册和器械列名
- 产品出口
美国FDA对医用口罩的标准要求
美国FDA关于医用口罩标准为《ASTM F医用口罩材料性能标准规范》,该标准为美国及日本的现行医用口罩标准,按照ASTM F2100标准生产的医用口罩按照防护级别分为低等防护(Level 1 Barrier)、中等防护(Level 2 Barrier)和高等防护(Level 3 Barrier)3个等级。
该标准主要在细菌过滤效率、颗粒过滤效率、抗合成血液穿透、阻燃性能和压力差5个方面进行测试,对于其他指标没有要求。ASTM F2100-19中的性能要求如下:
| 测试项目 | Level 1 Barrier | Level 2 Barrier | Level 3 Barrier |
| 细菌过滤效率/% | ≥95 | ≥95 | ≥95 |
| 压力差/mmH2O/CM2 | <5.0 | <6.0 | <6.0 |
| 亚微米微粒过滤效率/%(在0.1微米) | ≥95 | ≥98 | ≥98 |
| 抗合成血液穿透,最小压力/mm Hg | 80 | 120 | 160 |
| 阻燃 | 1级 | 1级 | 1级 |
众所众知,出口至美国的医用口罩必须取得美国FDA注册许可。FDA是食品药品监督管理局(Food and Drug Administration)的简称,是美国政府在健康与人类服务部 (DHHS) 下属的公共卫生部(PHS) 中设立的执行机构之一。FDA认证基本上遵循了ASTM F2100标准。
中国、美国、欧洲和澳大利亚标准医用口罩核心项目的对比
可以通过各国对医用口罩性能要求指标了解他们之间的差异,如下表,列出了主要性能指标要求情况。
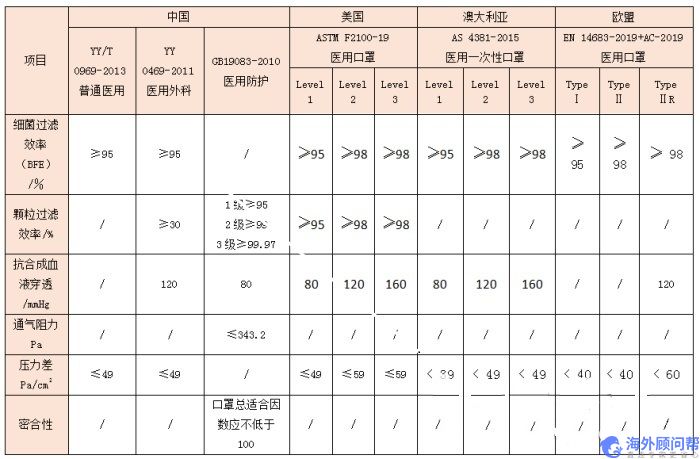
从表中可以看出:
1、在医用口罩的标准中,国内外的标准中的主要指标要求基本一致,都对细菌过滤效率、抗合成血液穿透、压力差等进行了规定。
2、而美国ASTM F2100标准和中国的GB 19083还对颗粒过滤效率提出了要求,不同的是两个标准的检测方法有所不同,ASTM F2100采用的是乳胶粒子测试亚微米颗粒过滤效率,而GB 19083是采用氯化钠颗粒模拟气溶胶测试计数中位径为0.075±0.020μm的颗粒过滤效率,对颗粒物过滤能力要求更严,能起到更高的防护作用。
3、中国的GB 19083医用防护口罩引入了适合因子,对口罩和面部的密封性能来进行密合性测试,这是防护口罩的一个重要指标,影响口罩防护能力和水平。
以上就是关于“医用口罩出口美国有哪些要求?”的相关要求,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为FDA认证提供一站式服务,咨询电话: 400-106-2206。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








