FDA紧急使用授权与FDA批准之间有何区别?
紧急使用授权概述及其与正常疫苗批准的区别。
美国食品和药物管理局(FDA)已发布了前两种紧急使用的COVID-19疫苗,预计其他疫苗也将陆续推出。一些消费者可能对“紧急使用授权”的含义以及与正常疫苗批准的区别有疑问。今天小编就给大家讲解一下。

在突发公共卫生事件中,可以通过紧急使用授权或EUA简化疫苗的生产和批准。EUA不会影响疫苗的安全性,因为它不会影响研发,例如研究,临床研究以及对副作用和不良反应的研究。相反,它可以加快制造和管理流程。
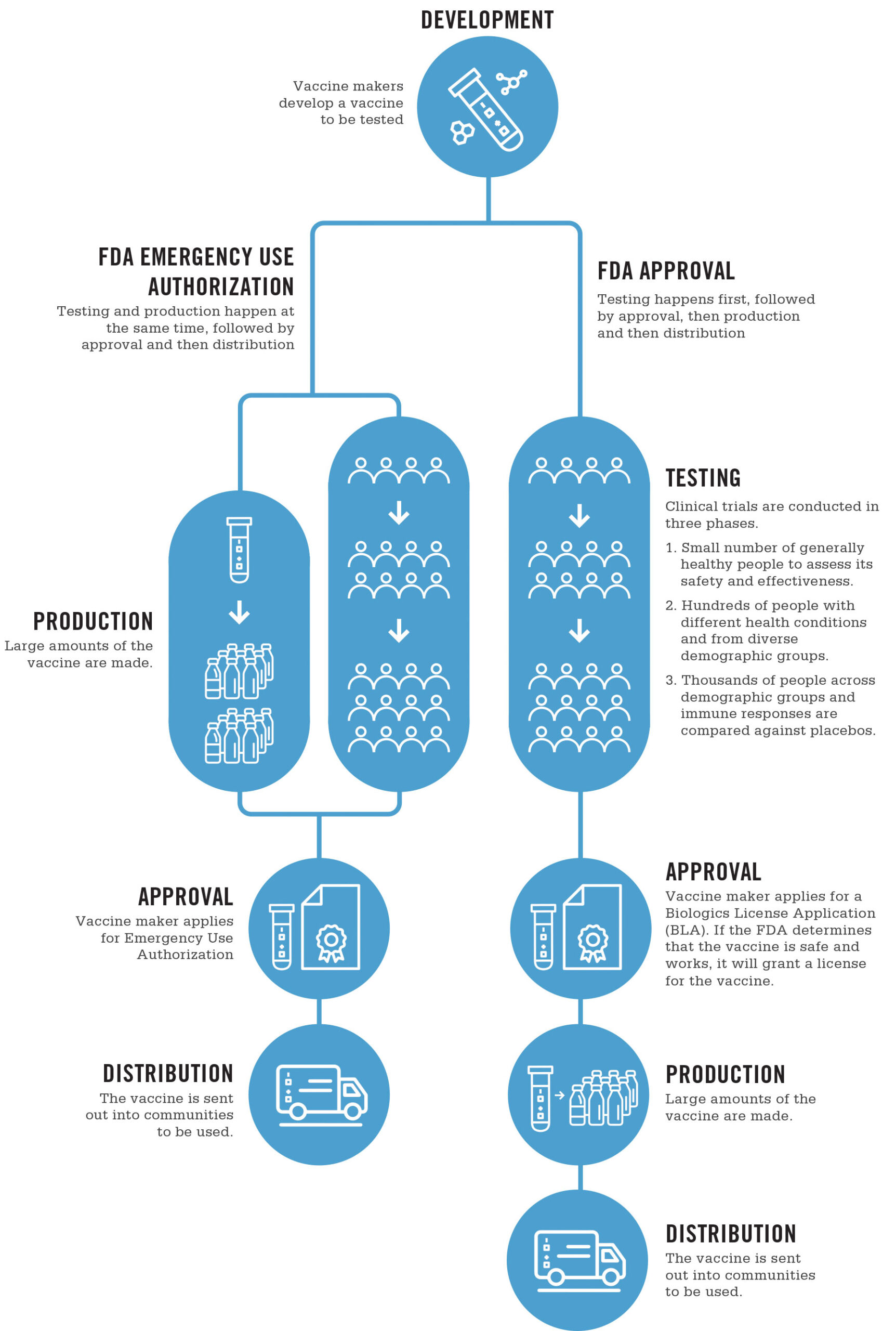
所有疫苗都经过相同的测试过程,无论它们被批准用于紧急用途还是通过典型的许可。
临床试验分三个阶段进行:
在第1阶段,将疫苗注射给少数总体健康的人,以评估其安全性和有效性。
在第2阶段中,疫苗是针对数百名健康状况各异且来自不同人群的人群提供的。
在第3阶段,该疫苗已向不同人口群体的数千人给药,并且将免疫反应与安慰剂进行了比较,安慰剂是不包含任何疫苗的剂量,仅用于测试目的。
一旦完成了3期试验,FDA将审查数据以确定该疫苗是否有效和安全。如果是这样,则制造商将申请批准。
这是由于公共卫生突发事件(例如COVID-19大流行)而可能改变流程的地方。
通常,制造商会申请《 生物制品许可证申请》(BLA)。如果FDA确定该疫苗安全,可行并且可以安全,一致地进行生产,它将获得该疫苗的许可证。
在突发公共卫生事件中,生产可能会在疫苗仍在研发中时进行,而不是在批准之后进行。这些工作是同时进行的,制造商无需申请BLA,而可以申请紧急使用授权。
如果收益超过疫苗的任何可能风险,并且可以确保生产质量,则FDA将批准该疫苗用于紧急用途。
紧急使用授权是解决公共卫生紧急情况和结束COVID-19大流行的重要组成部分。
以上就是关于“FDA紧急使用授权与FDA批准之间有何区别?”的相关内容,了解更多请点击咨询。

美国FDA认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








