出口德国的医疗器械需要做什么认证?
出口德国的医疗器械需要做什么认证?
由于德国是欧盟成员国,因此它遵循的是欧盟医疗器械指令(MDD)的设备分类系统,不久将被欧盟医疗器械法规(MDR)取代。 德国的医疗设备分类分为四个基于风险的类别:I,IIa,IIb和III。第一类风险最低,而第三类风险最高。
医疗器械注册流程
在欧盟范围内注册的所有医疗设备都必须获得CE标志。CE标志是一种广泛接受的已知符号,表示该设备符合当前欧盟标准下的所有法规和要求。CE标志还允许该设备在所有欧盟成员国内自由销售。CE标志的目的是节省制造商分别在28个不同国家/地区准备,提交繁重的卷宗所需的时间,成本和精力。带有CE标志的公司可以在所有欧盟成员国同时销售和销售其产品,无论是德国, 法国 还是 克罗地亚。但是,一些欧盟成员国要求在产品在该国销售或销售之前有一些其他要求。
请注意,要获得CE标志,外国制造商必须首先任命授权代表(AR),尤其是如果他们在欧盟中没有任何代表。AR可以位于任何欧盟成员国中。它们的主要作用是充当公告机构,代理与制造商之间的联络人。AR将协助注册过程并执行所有售后监督活动。

欧盟授权代表
此外,制造商必须具有质量管理系统(QMS)。最广泛接受的QMS是ISO 13485认证,有效期为三年。
德国是欧盟中除CE标志之外还要求其他要求的国家之一。BfArM有一个称为DIMDI的电子门户。制造商必须完成以下任务:
- 如果产品的制造商,进口商或AR在德国注册为公司,则一旦设备投放市场,他们必须使用DIMDI 系统通知BfArM 。
- 分配安全员,并在同一DIMDI系统上进行通知。
- 所有标签和使用说明必须使用德语。
- 不良事件报告应 根据医疗设备的性质向相应机构报告 。

气候友好承诺认证
市场概况
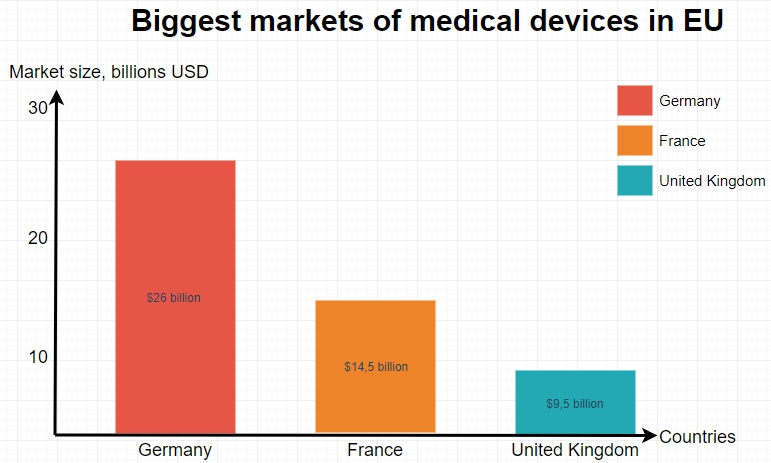
德国拥有欧洲最大的医疗设备市场,并且是世界第三大市场。就欧洲市场规模而言,德国最大的竞争对手是英国和法国。
- 德国医疗器械市场规模:260亿美元
- 英国医疗器械市场规模: 95亿美元
- 法国医疗器械市场规模:145亿美元
尽管德国拥有世界上一些最大的医疗设备公司,但它还是由中小型企业(SME)主导的。德国乐于接受新技术和创新技术来支持其高度认可的医疗服务。
德国需求最大的产品包括尖端技术,诊断和治疗设备以及无创或微创医疗设备。
正确遵循德国的医疗器械法规将有助于您增加市场地位。
关于海外顾问帮
海外顾问帮是协助国内企业和个人跨境发展的一站式服务中心,无需医疗设备公司花费数月的时间来收集情报并准备注册申请,以将其产品带到德国和任何其他国家。我们可以为您简化医疗器械注册流程,还在等什么,快来联系我们。

医疗产品CE认证
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








