MDCG 医疗器械软件视觉指南
医疗器械协调组 (MDCG) 是欧盟委员会的一个咨询机构,专注于进一步改进医疗器械领域的法规,发布了一份新的视觉指南,描述了在确定相关软件是否属于医疗设备。

该文件的范围包括医疗器械软件和体外诊断医疗器械软件。 根据该文件,医疗器械软件 (MDSW) 被定义为 旨在单独或组合使用的软件,其目的符合《医疗器械法规》2017/745 (MDR) 中“医疗器械”定义中的规定。 ) 或体外诊断医疗器械法规 2017/746 (IVDR)。
监管背景
如本指南所述,确定需要审查的软件是否为医疗器械的方法基于2019 年 10 月早些时候发布的MDR 和 IVDR 下软件资格和分类的MDCG 指南。
上述文件概述了适用于此类确定的标准,旨在为医疗器械制造商和其他各方提供有关此事的额外说明和建议。该文件还描述了与将医疗软件投放到欧盟市场相关的某些方面。需要注意的是,文档中描述的方法也适用于移动应用程序,以及作为基于云的服务运行的应用程序。因此,无论软件所基于的特定平台如何,都应该应用相同的方法。
首先,该文件提供了医疗器械软件上下文中使用的最重要术语的定义,即:
- 预期用途 – 根据制造商在标签、使用说明或促销或销售材料或声明中提供的数据以及制造商在临床评估中指定的数据,器械的预期用途。
- 附件 – 虽然本身不是医疗器械,但其制造商打算与一个或多个特定医疗器械一起使用的物品,以专门使医疗器械能够按照其/其预期目的或根据其预期目的专门和直接协助医疗器械的医疗器械功能。 MDCG 还提到 软件附件可能正在推动或影响医疗设备的使用。 此外,制造商提供的使用说明和其他文档应包含有关选择适当软件和附件的方式的详细信息。
- 软件代表 一 组处理输入数据并创建输出数据的指令。
MDCG 指南中提到的最重要的概念之一是软件驱动或影响设备的使用。根据该文件,该概念涵盖不具有独立功能且仅用于驱动硬件医疗设备操作的软件。此类软件可能旨在操作或控制硬件医疗设备或提供输出。这种软件也可以作为医疗设备的附件。
医疗器械软件测定
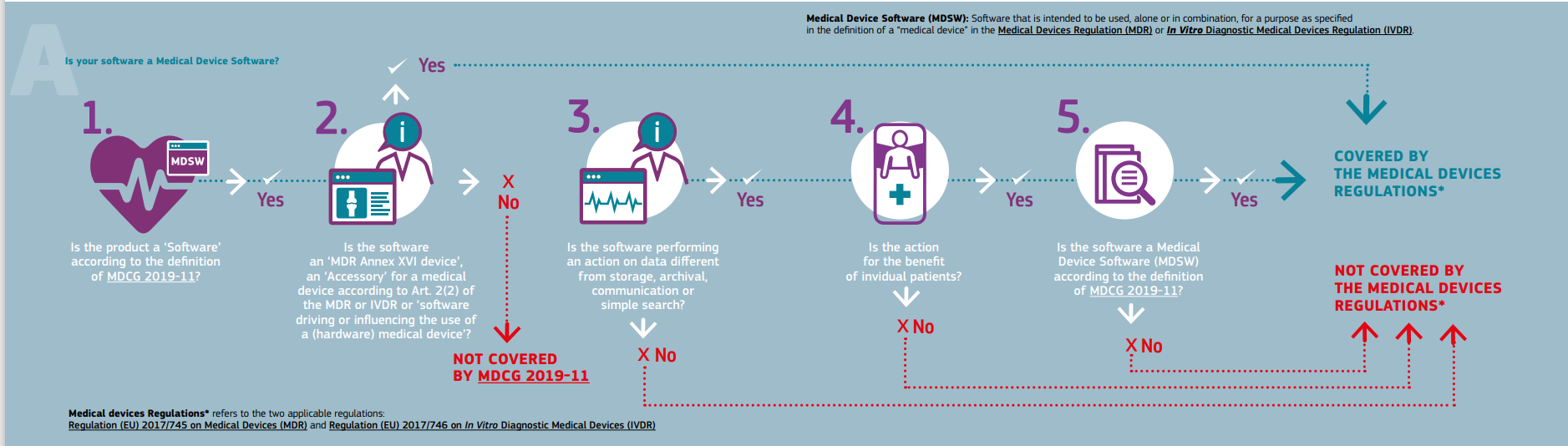
第一个流程图描述了适用于通用医疗设备软件的方法。根据流程图,如果该软件符合以下标准,则应受监管:
- 符合医疗器械及其附件的定义,或驱动医疗器械的运行,或
- 它执行额外的数据处理(不仅是存储或通信),其行为为患者创造利益,也符合上述 MDCG 指南中医疗设备软件的定义。
如果被审查的软件不符合上述标准,则该软件将不属于医疗器械法规的范围。
体外诊断医疗器械软件测定
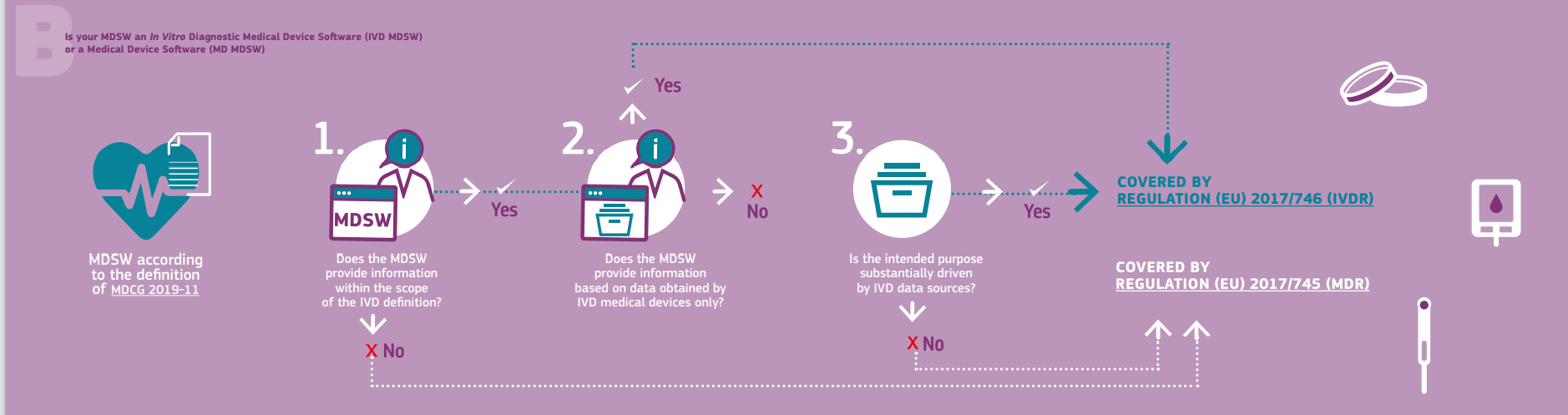
除了通用医疗器械软件外,MDCG 还提供了一个流程图,描述了将用于体外诊断产品的方法。
为确定所涉软件是否应受医疗器械框架下的监管,利害关系方应确定其是否满足以下标准:
- 符合医疗器械及其附件的定义,或驱动医疗器械的运行,或
- 它提供通常由体外诊断医疗器械提供的信息,也仅提供从体外诊断医疗器械收集的信息,或
- 该软件的预期用途与 IVDR 事项有关。
上述两个流程图旨在帮助医疗器械制造商(软件开发商)确定他们将要投放市场的软件产品是否受适用医疗器械框架的监管。
医疗器械软件:营销和符合性评估
MDCG 对用于医疗目的的软件进行分类的指南还强调了相关各方需要考虑的其他重要方面。
特别指出, 医疗器械软件和器械之间的互连类型不影响软件作为 MDR 和 IVDR 下器械的资格(例如,该软件是否被纳入器械或处于不同的地点)。中号edical设备软件既可以存在,作为一个独立的产品或在硬件设备中。
该指南进一步阐明了与上述两类软件相关的监管要求,即:
1. 医疗器械软件作为独立产品,应根据适用法律对其资格和分类进行全面监管。
2. 医疗器械软件是硬件医疗器械的组成部分或一部分,可以按照简化程序投放市场。特别是,它不会被单独审查,而是在硬件医疗设备本身的总体评估过程中受到审查。MDCG 还强调了考虑软件预期用途的重要性。
MDCG 指南中提到的另一个重要概念与医疗设备软件可能具有的模块有关。MDCG 承认,其中一些模块可能具有医疗用途,而其他模块则可能没有。
为了澄清有关此类软件监管状态的担忧,MDCG 指出,属于医疗器械框架范围内的模块应符合适用的监管要求。因此,它们应标有 CE 标志。同时,非医疗用途的模块不需要符合医疗器械的监管要求。
总结以上提供的信息,MDCG 制定了详细的建议,供医疗器械制造商(软件开发商)和其他相关方考虑。这些建议涵盖了与医疗器械软件分类和确定要应用的监管要求相关的最重要方面。

医疗产品CE认证
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








