欧盟MDR新法规医疗器械如何分类
欧盟MDR医疗器械分类
确定医疗器械分类和相应的分类规则是欧盟CE 标志流程的第一步。根据设备的类别和规则,可以提交技术文件和公告机构申请。
根据欧盟 MDR 2017/745 第 51 条,医疗器械根据其预期用途和固有风险分为 I、IIa、IIb 和 III。风险从 I 级增加到 III 级。欧盟医疗器械指令 (MDD) 和欧盟医疗器械法规 (MDR) 都使用基于规则的医疗器械分类模式。在新的 MDR 中,附件八现在有 22 条规则。
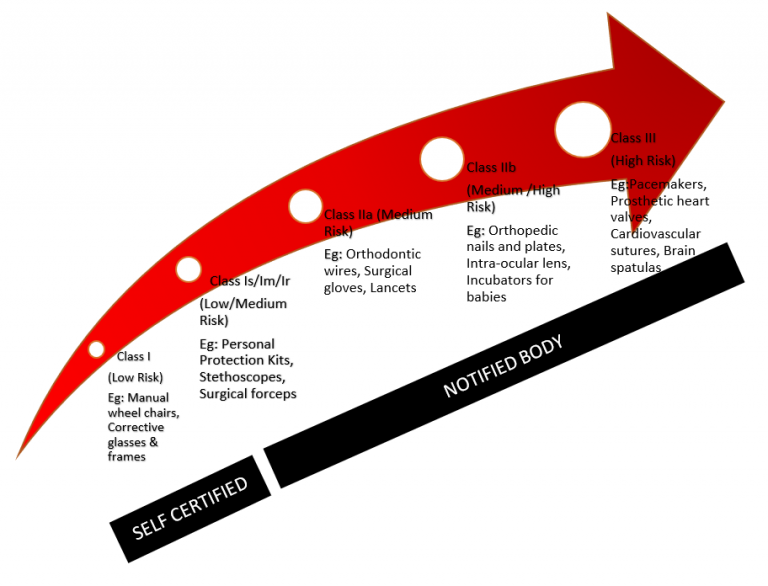
医疗器械分类举例
I级 - 低风险
- 示例:矫正眼镜和框架、手动轮椅
- 认证类型:自我认证/自我声明
1s 级低风险(无菌)
- 示例:个人防护用品、无菌尿袋等。
- 认证类型:公告机构
1m 级低风险(测量体属性)
- 示例:听诊器、天平
- 认证类型:公告机构
1r 级低风险(重复使用的设备)
- 示例:手术钳(所有类型的 SS/Tit 手术设备已消毒并由医院重复使用)
- 认证类型:公告机构
IIa 类 - 中等风险
- 示例:正畸线、手术手套、柳叶刀
- 认证类型:公告机构
IIb 类 - 中高风险
- 示例:矫形钉和钢板、人工晶状体、婴儿保温箱
- 认证类型:公告机构
III 类 - 高风险
- 示例:起搏器、人工心脏瓣膜、心血管缝合线、脑刮刀、药物-器械组合产品
- 认证类型:公告机构
医疗器械分类规则
根据 MDR 的附件八,分类规则如下:
- 规则 1-4:非侵入性设备
- 规则 5 – 8:侵入性设备
- 规则 9 – 13:有源设备
- 规则 14 – 22:特殊规则
以上就是关于“欧盟MDR新法规医疗器械如何分类”的相关内容,如果您想了解更多信息或办理医疗器械MDR认证,请咨询在线客服或致电:400-106-2206。

医疗产品CE认证
推荐指数:
项目简介:医疗器械CE认证,MDD,MDR,ISO 13485质量管理体系,欧盟授权代表 查看详情>>
版权声明:本站内容源自互联网,如有内容侵犯了你的权益,请联系删除相关内容。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








