FDA将全面实行510(k)无纸化提交
2021年9月29日,美国食品药品监督管理局(FDA)发布了一份全新指南,提出在2022.9.30之前(也即美国2022财年内)将会正式公布510(k)电子提交制度的全面实行日期,同时也将会留给广大申请厂家至少一年的过渡期。届时,这份草拟指南也将更新为正式版本,供申请企业来参考执行。对该指南如有相关的建议,可以在2021.11.28之前提供给FDA,感兴趣可以详细阅读。
不仅是预计的执行时间,这篇指南还给出了即将与电子提交系统配套使用的文件准备模板。目前看起来,涉及的内容章节与当前的510(k)要求不会有非常大的出入,但形式会有一些调整,该电子提交系统会整合进FDA相关数据库的资源信息(如FDA产品分类码[Product Code],FDA认可标准[Recognized Consensus Standards]等),并采用一些特定的方式来采集需申请人提供的信息及数据,以供FDA进一步审核。
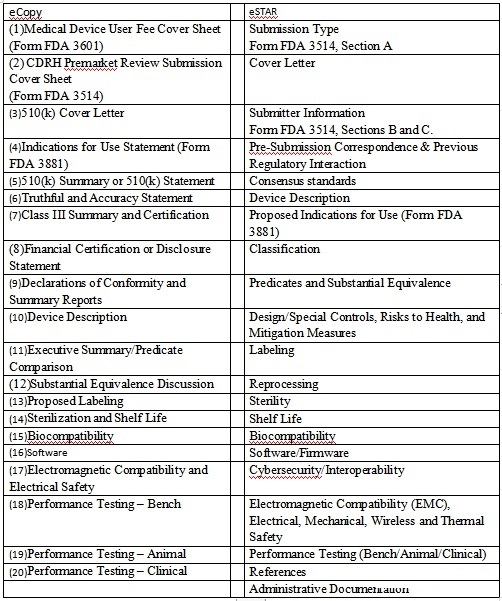
具体的文件要求,操作方法以及实施时间还需要FDA的进一步正式告知。目前使用的邮寄光盘的资料提交方式也将退出FDA的历史舞台。这对于企业来说也不失为一个好消息,毕竟不需要将资料刻录进光盘中,避免掉这个过程中可能出现的文件损坏。也不用通过国际物流将资料提交给FDA,运输时间同样也是个不可控的因素,今后都不再需要考虑物流时间和成本的问题。对于有出口美国要求的企业,申报流程会变得更简洁方便。将目前实施的提交的510(K)的内容和eSTAR的格式内容罗列如下表所示:
以上就是关于“FDA将全面实行510(k)无纸化提交”的相关内容,如果您想了解更多信息或办理医疗器械FDA 510(k)注册,请咨询我们的在线专家或致电:400-106-2206。

美国FDA认证
推荐指数:
项目简介:食品、化妆品、医疗器械、激光辐射产品等FDA认证,510(k)注册,FDA验厂指导,DUNS申请,美国代理人服务 查看详情>>
版权声明:本站内容源自互联网,如有内容侵犯了你的权益,请联系删除相关内容。
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








