质量管理体系和ISO13485
ISO13485是统一标准,它规定了医疗设备质量管理体系(QMS)的要求。
所以,医疗设备制造商必须首先根据ISO13485进行认证,因为根据医疗设备指令MDD的附录II,他们可以自行解释其产品的合规性。对于包含软件或独立软件的医疗设备,IEC62304还要求QMS并建议使用ISO13485。

质量管理体系的有效性将由外部审核员(通常是指定机构)和内部审核员进行检查。
ISO13485常见问题解答
1. 我需要一个(认证的)质量管理体系吗?
如果您的产品不在I类中,则您很可能需要认证的QM系统。仅基于MDR附录IV(EC验证)或MDR附录XI B部分的合格评定程序不需要经过认证的QM系统。但是,这种方法是个例外。
如果您的产品属于I级,则存在MDR和IEC62304要求的QM系统。但是,此QM系统不必经过认证。
2. 我已经拥有ISO9001证书。还需要ISO13485吗?
不需要。如果您需要经过认证的QM系统(请参阅问题1),则仅ISO13485认证就足以证明符合法规要求。
3. 谁可以认证我的QM系统?
只有经过认证的机构才能证明您的质量管理体系。他们必须具有“附件证书”的认证。
4. 建立和认证QM系统需要多长时间?
通常,从项目开始到审核分别需要六到九个月的时间。当前,指定机构的可用性是一个问题。
中小型公司必须投资30至50人日。但是,运行质量管理系统需要持续的努力来分别审计,改进和重新认证系统的过程。
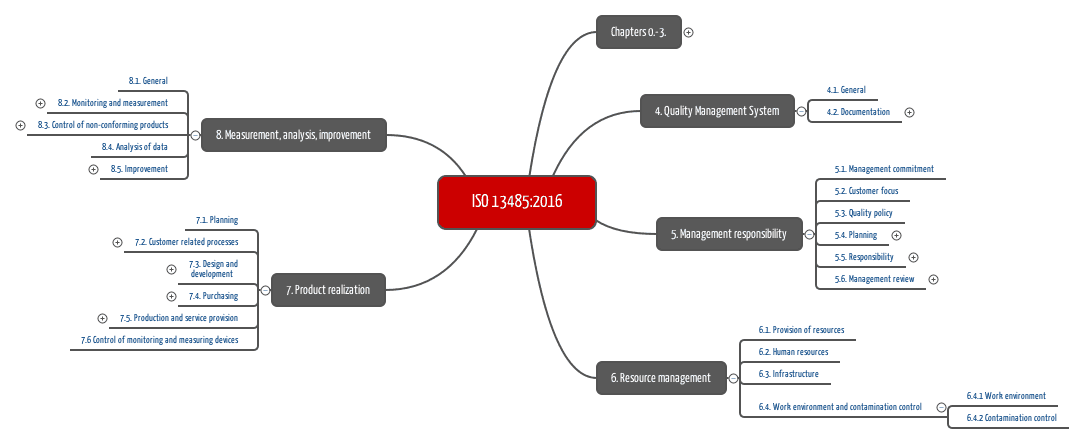
ISO13485:2016的要求
ISO13485:2016是(唯一)证明符合与质量管理体系有关的法规要求的标准。
为了建立这样的质量管理体系,您必须:
1. 描述您的组织,包括质量策略,目标和层次结构
2. 描述您的组织流程。其中,这些过程必须涵盖
- 发展历程
- 生产
- 服务提供
- 风险管理
- 文件控制
- 内部审核
- 管理评审
- 纠正和预防措施
- 处理资源(人力资源,基础设施,设备,位置)
- 与客户沟通
3. 分配财务和人力资源,包括质量管理代表
相应地执行这些流程,并通过记录您所做的事情来证明这一点
建立符合ISO13485的质量管理体系的步骤
1. 步骤:定义范围
根据您的活动,定义质量管理体系的范围:
- 发展:是/否,产品类型
- 生产:是/否,生产类型,例如灭菌,电路板生产
- 服务:是/否,服务类型,例如安装,维护,热线,培训
- 合法制造商与服务提供商
- 与客户(最终用户,其他公司)和供应商的接口
2. 步骤:选择通知的主体
当前,对认证机构的需求很高,因为许多认证机构都失去了认证。因此,重要的是要在过程中尽早选择您指定的机构。
3. 步骤:建立质量管理体系
现在,您开始根据标准操作程序,工作说明,模板,表格,清单等来定义“规则”:
- 识别所有过程
- 识别所有过程的输入和输出
- 描述流程之间的相互依赖性
- 描述/建模流程
- 定义方法和说明如何执行每个过程步骤。(可选)在工作说明中提取这些要求。定义必须如何记录这些过程步骤,例如使用模板,清单或计算机系统。
确保满足法规要求(特别是ISO13485:2016或21 CFR part 820)要求的所有过程。
4. 步骤:根据您的质量管理体系进行工作
您的公司现在开始根据这些过程描述(SOP)和工作说明(WI)工作。它生成证明符合的“记录”。例如,您的团队填写表格,模板和清单,或按照说明使用计算机系统。
5. 步骤:准备审核
在最终审核之前,请确保已准备就绪:
- 内部审计
- 管理层对质量管理体系进行了审查
- 团队根据SOP和WI工作
- 外部供应商已通过审核
- 电脑系统已通过验证
6. 步骤:接受审核
根据组织的规模,指定机构将对您的公司进行两到十(甚至更多)天的审核。
以上就是关于“质量管理体系和ISO13485“的相关内容,了解更多请咨询海外顾问帮。
【海外顾问帮】是协助国内企业和个人跨境发展一站式的服务中心,协同全球专家顾问,坚持透明服务,打破跨境壁垒,为ISO13485认证提供一站式服务,咨询电话: 400-106-2206。

ISO13485质量管理体系认证
直连专家
 邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司
邮件群发-邮件群发软件|邮件批量发送工具|群发邮件平台|批量邮箱发送系统公司








